Lezárult belföldi / Magyar Orvostudományi Nukleáris Társaság XXII. Kongresszusa
Tisztelt Kollégák, Kedves Barátaim és Minden Kedves Érdeklődő!
Nagy öröm és megtiszteltetés számomra, hogy ezúton is tájékoztathatom Önöket arról, hogy a Magyar Orvostudományi Nukleáris Társaság Kongresszusát 2022.05.19-21. között Szegeden a Hungest Hotel Forrásban tartja.
Az elmúlt évek Covid járványa nem kedvezett tudományos rendezvények megtartására. A kétévente esedékes MONT Kongresszust a vezetőség a tavalyi évben elhalasztotta, mivel csak online lebonyolításra lett volna lehetőség. A járvány az utóbbi időben kedvező fordulatot vett, és a megszorítások enyhítése az előrejelzések alapján a tavasz folyamán is kitart.
Most vettük a bátorságot, hogy az elmaradt rendezvényt megszervezzük és lehetőséget biztosítsunk a szakmánkban dolgozó munkatársaknak és minden a nukleáris medicina iránt érdeklődő kollégánknak a személyes találkozásra.
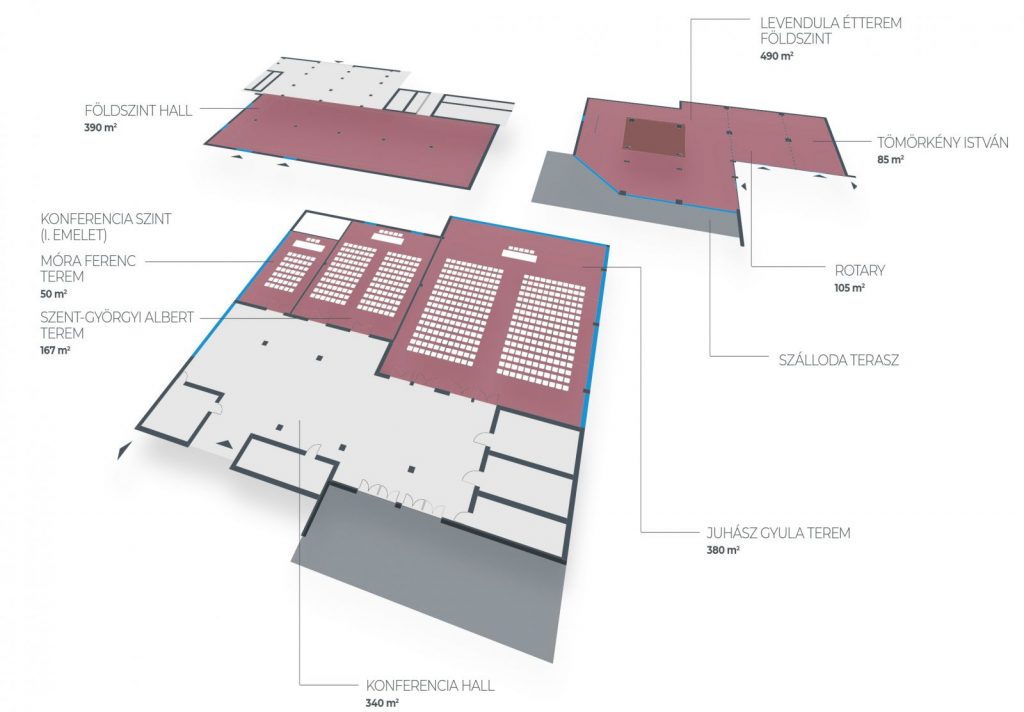
A helyszín kiváló wellness szolgáltatást is kínál a résztvevőknek, ami azonban reményeink szerint nem fogja eltántorítani a résztvevőket a tudományos programok látogatásától. A rendezvény helyszínén 400 nm kiállító tér, 450 fő részére szállás, étterem, 380 nm és 167 nm kongresszusi terem áll majd rendelkezésünkre.
Az absztrakt benyújtási, elbírálási, és a regisztrációs határidők szűkösek, kérem a rendezvény sikere érdekében ezek szigorú betartását.
Bízom benne, hogy a Szervező Bizottsággal és minden kedves résztvevőnk támogatásával ismét egy tartalmas, sikeres kongresszusnak nézünk elébe.
Baráti üdvözlettel,
Prof. Dr. Pávics László
a MONT és a Kongresszus elnöke

Akkreditáció:
A kongresszus akkreditálása folyamatban van!
A kongresszus technológusok számára is akkreditálásra kerül!
Dátumok:
Absztrakt benyújtás: 2022. március 31.
Az absztrakt feltöltése során kérjük, hogy a “Letölthető dokumentumok között szereplő űrlapot legyenek kedvesek feltölteni!
Végleges program, absztraktok elbírálása: 2022. április 07.
Kedvezményes regisztráció: 2022. április 20.
Regisztrációs díjak*:
| 2022. április 20-ig | 2022. április 21-től | |
| MONT tag | 45 000 Ft | 55 000 Ft |
| Nem MONT tag | 55 000 Ft | 65 000 Ft |
| Napijegy | 25 000 Ft | 25 000 Ft |
| Diák | ingyenes | ingyenes |
| Gálavacsora | 18 000 Ft | 18 000 Ft |
*Az árak tartalmazzák az ÁFA-t!
Szállás díjak*:
| Hunguest Hotel Forrás | Novotel Hotel | |
| Kétágyas szoba 1 fő részére reggelivel | 27.800 Ft/szoba/éj | 33.400 Ft/szoba/éj |
| Kétágyas szoba 2 fő részére reggelivel | 40.000 Ft/szoba/éj | 36.500 Ft/szoba/éj |
| Apartman 1 fő részére reggelivel | 39.500 Ft/szoba/éj | – |
| Apartman 2 fő részére reggelivel | 51.700 Ft/szoba/éj | – |
*Az árak tartalmazzák az ÁFA-t és az IFA-t!
Étkezés díjak*:
2022. május 19. csütörtök – ebéd: 3 500 Ft/fő
2022. május 20. péntek – ebéd: 5 500 Ft/fő
2022. május 20. péntek – vacsora: 18 000 Ft/fő
2022. május 21. szombat – ebéd: 5 000 Ft/fő
*Az árak tartalmazzák az ÁFA-t!
Regisztráció lépésről-lépésre:
1. Saját fiók létrehozása: https://regio10.hu/fooldal/my-account/
A rendezvényre a Régió-10 Kft. weboldalán, csak saját fiókkal lehet regisztrálni. Kérjük, hogy a “Regisztráció” mező adatait kitöltve hozzanak létre egy fiókot.
2. Saját fiók adatainak kitöltése:
Kérjük, hogy a regisztráció aktiválása után személyes adatait töltse ki.
3. Regisztráció a konferenciára:
Az adatok kitöltése után a “Rendezvények” menüben válassza ki a Magyar Orvostudományi Nukleáris Társaság XXII. Kongresszust és a “Regisztráció” gombra kattintva küldje be jelentkezését a konferenciára.
Az absztrakt beküldése nem jelent automatikus regisztrációt a konferenciára! Amennyiben absztraktja elfogadásra került, de még nem regisztrált a konferencia, kérjük mielőbb tegye meg!
1. nap – 2022. május 19. csütörtök:
11:00 – 12:00 Megnyitó
12:00 – 13:00 Welcome fogadás
13:00 – 14:00 Bőrgyógyászat a XXI. Században
Prof. Dr. Kemény Lajos (Akadémikus)
“A” szekció
14:00 – 16:00 Klinikum I.
Elnökök: Schmidt Erzsébet, Györke Tamás
Sipka Gábor
Az áttétes neuroendokrin daganatok szomatosztatin receptor expressziójának összehasonlítása a radiomika módszereivel Tc-EDDA/HYNIC-TOC (tektrotyd) vizsgálatokban
Farkas István
A 99mTc-I&S PSMA SPECT/CT diagnosztikus paraméterei a primer prosztatarákban és biokémiai relapszusban
Nádasdy-Horváth Domonkos
Kezdeti tapasztalatok 18F-JK-PSMA-7 PET/CT vizsgálattal prostata adenocarcinoma biokémiai relapsusában
Kelemen Gyöngyi
18F-DOPA PET/CT szerepe a központi idegrendszere daganatok kezelésében
Mikó Zsófia
Tapasztalataink gliomás betegeken végzett dinamikus 18F-DOPA PET/CT-vel recidív tumoros folyamat kimutatására
Jánosa Cintia Barbara
Tapasztalataink 18F-fluorokolin PET/CT vizsgálattal mellékpajzsmirigy adenoma kimutatására
Tóth Zoltán
Mellékpajzsmirigy adenoma lokalizációs indikációjú multimodális 18F-Kolin PET vizsgálatokkal szerzett kezdeti tapasztalatok
Száraz Lili
COVID-19 betegség vizsgálata és követése agyi PET/CT vizsgálattal
Szugyiczki Viktória
Szokatlan perfúziós mintázat COVID-19 fertőzött betegek tüdőszcintigráfiás perfúziós SPECT/CT felvételein
Jóba Róbert Péter
A COVID-19 megbetegedés és COVID-oltás utáni kardiális panaszok háttere a szívizom szcintigráfia tükrében
Czibor Sándor
CT-morfológiai és PET-metabolikus paraméterek összehasonlítása COVID-19 pneumoniában
“B” szekció
14:00 – 16:00 Asszisztens továbbképzés
Elnök: Barna Sándor
Nagy Gábor
Új irányvonalak az izotópterápia területén
Barna Sándor
Gammakamerás újdonságok a nukleáris medicinában
Pongrácz Barbara
Technológusi feladatok a PET/CT vizsgálatnál
Patkó Zsófia
Ritka vizsgálatok a nukleáris medicinában
16:00 – 16:30 Kávészünet
“A” szekció
16:30 – 18:30 Klinikum II.
Elnökök: Zámbó Katalin, Garai Ildikó
Ritter Zsombor
Texturális paraméterek és gépi tanulás jelentősége a lymphomák diagnosztikájában, prognosztikájában és a terápia nyomonkövetésében
Czékus Tamás
A terápia előtti 18F-FDG PET/CT vizsgálat prognosztikai értéke perifériás T-sejtes lymphomás betegeknél
Olajos Mirella
Nem tapintható tüdőgócok minimál-invazív műtéti eltávolítása izotópos jelölés segítségével
Kiss Fanni Júlia
Tüdőtumor molekuláris patológiai tulajdonságainak és FDG-felvételének összehasonlítása
Bakos Annamária
99mTc-Mebrofenin SPECT/CT szerepe a máj funkcionális térfogatának preoperatív meghatározásában
Szili János
Lymphoszcintigráfia segítségével végzett sentinel node biopszia szerepe hímvessző carcinómában
Szkibák Noémi
Pajzsmirigyben kialakuló forró göbök diagnosztikája, követése és terápiája
Bencze Viktória
A könnyszcintigráfiás módszer új szemészeti alkalmazása
Képes Zita
Az életkor, a BMI és a diabetes, mint agyi perfúziót befolyásoló független tényezők
Barna Sándor
Histero-szalphingo szcintigráfia jelentősége a SPECT/CT korában
Mihovk Iván
Retrobulbáris 99mTc-DTPA SPECT/CT kvantitatív értékelése és összevetése a korábbi SPECT eredményekkel
“B” szekció
16:30 – 17:30 Mediso Symposium
Bagaméry István, Forgács Attila, Gémes Dániel, Barna Sándor
A háromdetektoros SPECT/CT-től a hárommodalitású SPECT/CT/PET-ig
19:00 – 20:00 MONT Közgyűlés
2. nap – 2022. május 20. péntek:
09:00 – 10:00 Genetika az orvostudományban 2022
Prof. Dr. Lakatos Péter (MTA doktora)
“A” szekció
10:00 – 12:00 Nukleáris medicina technika
Elnökök: Varga József, Séra Emese
Mikó Zsófia
Automatikus tüdőszegmentáló program hatékonyságának vizsgálata tüdőnodulus miatt vizsgált betegekben: kezdeti eredményeink
Urbán Szabolcs
Agyi vérátfolyás SPECT vizsgálatok automatikus kvantitatív elemzése: előzetes eredmények
Fábián Krisztián
Metabolicus heterogenitás lymphomákban, 18FDG-PET/CT vizsgálattal
Kolozsi Zoltán
CT dózis optimalizálás nukleáris medicina munkahelyek hibrid képalkotó vizsgálatainál
Kulcsár Tamás
Újonnan üzembe helyezett PET/CT berendezés gyűjtési protokoll optimalizációja
Vas Norman Félix
A debreceni MiniPET kamerák leképzési tulajdonságai 10 évvel a telepítés után
Kári Béla
Izotópos Szívizom SPECT Vizsgálatok Leképezési Paramétereinek Optimálása
Kiss János
3D nyomtatott antropomorf szívfantom nukleáris medicina alkalmazásokhoz
Czékus Tamás
Manuális és automatikus mozgáskorrekció hatása kisgyermekek kamera-renográfia vizsgálatainak eredményeire
Urbán Szabolcs
Fél-automatikus szervszegmentáló SPECT/CT képeken
Urbán Szabolcs
Automatikus bordacimkézés SPECT/CT és PET/CT felvételeken
Budai Ádám
MultiPinHole kollimátor technikai előnyei DaTscan SPECT/CT vizsgálatokban
Krizsán Áron Krisztián
Új multi-pinhole kollimátor és háromdetektoros SPECT technika képminőségének tesztelése nukleáris kardiológiai applikációkhoz
“B” szekció
10:00 – 11:00 Asszisztens továbbképzés
Elnök: Trencsényi György
Trencsényi György
Mire a human vizsgálat rutin lesz – a kutatás jelentősége
Tóth Zoltán
18F-Kolin PET/CT alkalmazása prosztata tumoros betegcsoportban
11:00 – 12:00 Közgyűlés, Tisztújítás
12:00 – 13:00 Ebéd
13:00 – 14:00 Esetismertetések I.
Elnök: Besenyi Zsuzsanna
Sághy László
Szív sarcoidosis és primer tüdőtumor diagnosztikája FDG-PET/CT-vel
Kisiván Tímea
Nesidioblastosis fokális formájának igazolása DOPA PET/CT vizsgálattal
Papp Zsombor Mátyás
A melanómához kapcsolódó sentinel nyirokcsomó-szcintigráfia időzítésének jelentősége
Kelemen Nándor Richárd
Tüdődaganat mikrohullámú ablációjának tervezése és 24 órán belüli 18F-FDG PET/CT kontrollja – esetismertetés
Piroska Márton
99mTc-MIBI szcintigráfiás vizsgálattal akcidentálisan felfedezett carcinoid tüdőtumor
Szabó Péter
FET PET-CT-vel végzett neuro-onkológiai vizsgálatok, esetek bemutatása
Fendrik Gyula Farkas
18F-fluorokolin PET/CT-n talált incidentális pulmonalis adenocarcinoma – esetismertetés
Német Rita
Neurolyphomatosis diagnosztikája FDG-PET/CT-vel
“A” szekció
14:00 – 15:00 Klinikum III.
Elnökök: Barna Sándor, Tóth Zoltán
Sükösd Hunor
Halmoz és dúsít is? – Az egy ülésben végzett FDG-PET/CT és kontrasztanyagos nyaki CT vizsgálat jelentősége a fej-nyaki daganatok diagnosztikájában
Dezső Dániel
Benignus és malignus eredetű emésztőrendszeri dúsulások elkülönítése 18F-FDG PET/CT-vel
Laczkó Katalin
Transztiretin-típusú szímamiloidózis vizsgálata 99mTc-mal jelölt pirofoszfáttal
Német Rita
Agyi vascularis rezerv kapacitás megítélése a carotis rendszert érintő szűkületekben
Nagy Szanella
A nagy dózisú ablatív radiojód terápia hatékonyságának matematikai módszerekkel történő becslése differenciált pajzsmirigyrákos betegek esetében
Szentesi Margit
A radiosynoviorthesis 37 éve Magyarországon /1985-2022/
15:00 – 15:30 Kávészünet
15:30 – 16:30 Lézerfizika napjainkban
Prof. Dr. Szabó Gábor (Akadémikus)
16:30 – 17:30 Esetismertetések II.
Elnök: Besenyi Zsuzsanna
Mikó Zsófia
Aorta körüli tályog kimutatása FDG PET/CT-vel aortabillenytű cserén átesett betegben
Farkas Bence
Esetbemutatás: FDG-PET/CT szerepe Erdheim-Chester betegségben
Bakos Annamária
Erdheim-Chester betegség diagnosztikája
Német Rita
Multiplex tüdőgócok diagnosztikája egy rheumatoid arthritisben szenvedő betegben
Farkas István
Adenoid cystcius carcinoma vizsgálata 99mTc-PSMA-SPECT/CT-vel
Libor László
Multiplex májmetastasist adó neuroendocrin pancreas daganat komplex kezelése – esetismertetés
Sipka Gábor
F-DOPA PET/CT vizsgálat jelentősége MEN-2A szindrómában (esetismertetés)
Czékus Tamás
PSMA expresszáló mediastinalis incidentaloma – esetismertetés
Nagy Szanella
Kiterjedt csontmet nagy dózisú 131I radiojóddal történő terápiás menedzselése: esetismertetés
Nagy Petra
FDG PET-CT alkalmazási elvei myeloma multiplexben két tanulságos eseten szemléltetve
“B” szekció
14:00 – 15:30 Asszisztens előadások
Elnökök: Buga Klára, Kunné Vigh Ottilia
Kisiván Tímea
Fokozott barnazsírszöveti aktivitás előfordulási gyakorisága FDG PET/CT vizsgálatok során
Scheidl Ágota
Liquorcsorgás vizsgálatok a Semmelweis Egyetemen asszisztensi szempontból – csapatmunka nélkül nem megy
Albert Orsolya
Tüdőtumorok ablációját követő 24 órán belül végzett PET/CT vizsgálatok a Semmelweis Egyetemen
Görgeiné Vass Andrea
Tücsök és bogár – avagy a nukleáris medicina érdekességei
Pongrácz Barbara
A BMI hatása az FDG-vel vizsgált betegek dózisteljesítményére
Horváth Dorina
Légzés kapuzott FDG PET/CT vizsgálat tapasztalatai
Balog László
Tapasztalataink EKG kapuzott cardialis FDG PET/CT vizsgálatokkal
Visnyei Lilla
Prosztatadaganatok 99mTc-PSMA-SPECT/ CT alapú individuális sugárkezelésének kivitelezése a technológus szemével
15:30 – 16:00 Kávészünet
16:00 – 17:00 GE Symposium
Maxime Teisseire
Enhancing diagnostic confidence with digital SPECT imaging
17:30 – 18:00 Szakmai Kollégium (kerekasztal)
Levezető elnök: Pávics László
Résztvevők: Borbély Katalin, Besenyi Zsuzsanna, Garai Ildikó, Sinkó Mária, Györke Tamás
19:00 – Gálavacsora
3. nap – 2022. május 21. szombat
09:00 – 10:00 Preklinikai vizsgálatok
Elnökök: Jánoki Győző, Trencsényi György
Gyuricza Barbara
Galektin-3 fehérjét expresszáló melanoma sejtek kimutatására alkalmas laktóz-amin alapú radiofarmakonok szintézise és preklinikai vizsgálata
Toan Minh Ngo
In vivo analysis of HER2 receptor status with 52Mn-DOTAGA-trastuzumab radiopharmaceutical
Trencsényi György
APN/CD13 és αvβ3 integrin receptorok in vivo vizsgálata szingenikus tumoros állatmodellen
Szűcs Dániel
68Ga és 205/206Bi jelzett, albuminkötő egységgel módosított DOTA-konjugált NAPamid szintézise és preklinikai vizsgálata
Hajdu István
Gallium-68 jelölt ciklodextrin származékok előállítása és preklinikai vizsgálata
10:00 – 10:30 Szünet
10:30 – 11:30 Radiofarmakológia
Elnökök: Tóth Gyula, Antalffy Mária
Szeredy Patricia
68Ga-MAA helyi előállítása, minőség ellenőrzése és a klinikai forgalomban lévő referencia 99mTc-MAA termék összehasonlítása
Környei József
Perfúziós radiofarmakonok: a „gold standard” és versenytársai
Németh Klára
Új modul rendszerű média-fill kit kifejlesztése radiopharmakonok helyi előállítási folyamatának mikrobiológiai ellenőrzésére
Eller Gábor
Új, alternatív 18F-jelzett PSMA specifikus nyomjelzők szintézise, és preklinikai vizsgálata
Farkasinszky Gergely
[68Ga]Ga-PSMA-11 gyógyszerészeti fejlesztése és az „Investigational Medicinal Product Dossier” összeállítása humán klinikai fázis III vizsgálatokhoz
Vágner Adrienn
DOTAGA-trastuzumab molekula előállítása és 52Mn izotóppal történő jelzése
Baráthné Tóth Eszter
Ex tempore radiofarmakonok gyógyszerész szemmel
11:30 – 12:30 Radiofarmakonok engedélyeztetése (kerekasztal)
Meghívott előadó: Nagyné Dr. Szabó Andrea (OGYÉI)
Résztvevők: Antalffy Mária, Jánoki Győző, Tóth Gyula, Farkasinszky Gergely, Tóth Zoltán
12:30 – 14:00 Highlights és kongresszus zárása
Highlights előadók: Barna Sándor, Tóth Zoltán
14:00 – Búcsúparty
15:00 – Intézetlátogatás, Lézerközpont bemutatása (érdeklődéstől függően)
2022. május 19. csütörtök, 14:00 – 16:00, Klinikum I.
1. Az áttétes neuroendokrin daganatok szomatosztatin receptor expressziójának összehasonlítása a radiomika módszereivel Tc-EDDA/HYNIC-TOC (tektrotyd) vizsgálatokban
Sipka Gábor (1), Besenyi Zsuzsanna (1), Bakos Annamária (1), Mikó Zsófia (1), Nagy Szanella (1), Farkas István (1), Czékus Tamás (1), Urbán Szabolcs (1), Valkusz Zsuzsanna (2), Pávics László (1)
1: Szegedi Tudományegyetem Nukleáris Medicina Intézet
2: Szegedi Tudományegyetem Belgyógyászati Klinika, Endokrinológiai munkacsoport
BEVEZETÉS: A neuroendokrin daganatok (neuroendokrin tumorok és karcinómák) a malignus betegségeken belül is egy rendkívül heterogén, szerteágazó csoportot képeznek. A diagnózisukhoz és a legoptimálisabb terápia kiválasztásához egyaránt kulcsfontosságú a tumoros elváltozások, metasztázisok felszínén expresszálódó szomatosztatin receptorok igazolása. Vizsgálatunk célja az volt, hogy összehasonlítsuk és összefüggéseket keressünk a 99mTc-EDDA/HYNIC-TOC felvételeken igazolt neuroendokrin eredetű malignus léziók szomatosztatin-receptor expressziója és más specifikus, illetve aspecifikus szövettani, onkológiai, immunhisztokémiai és laboratóriumi paraméterek között távoli áttétes betegpopulációban.
MÓDSZEREK: Retrospektív elemzésünk során 66 szövettanilag igazolt távoli áttétes neuroendokrin daganatos beteg (30 nő, 36 férfi, átlagéletkor: 59 év) 99mTc-EDDA/HYNIC-TOC SPECT/CT felvételeit értékeltük ki kvantitatív és szemikvantitatív módszerekkel. A detektált léziók tulajdonságait különböző (lineáris és nemlineáris) matematikai analitikai módszerekkel számos (összesen 48 féle) onkológiai, szövettani, immunhisztokémiai és laboratóriumi paraméterekhez viszonyítottuk korrelációt keresve egyes faktorok, illetve több faktor kombinációja között.
EREDMÉNYEK: 66 beteg közül 16 fő neuroendokrin karcinóma, 50 fő neuroendokrin tumor diagnózisával került intézetünkbe. A vizsgálatok során összesen 392 db szövettanilag, vagy egyéb képalkotó vizsgálat (kontrasztos CT vagy MR) által igazolt léziót detektáltunk a 66 99mTc-EDDA/HYNIC-TOC SPECT/CT felvételen, melyek döntő többsége a májban (147/392), nyirokcsomókban (105/392) és a csontokban (55/392) észlelhető. A szomatosztatin receptor denzitás a vártnak megfelelően szignifikánsan különbözött a neuroendokrin karcinómás és tumoros betegpopulációban, illetve az immunhisztokémiai szomatosztatin receptor pozitivitás is egyértelműen igazolta a funkcionális képalkotó vizsgálat magas érzékenységét (Mann-Whitney, P<0,0001). A legtöbb tumor kromogranin-A, szinaptofizin és CD56 pozitívnak bizonyult, de legismertebb markereken kívül a CK7 (Mann-Whitney, P=0,0001) és TTF-1 negativitás (Mann-Whitney, P<0,0001) is fokozott szomatosztatin receptor denzitással függött össze. A laborparaméterek közül a normális tartományban lévő karcino-embrionális antigén szint is emelkedett szomatosztatin receptor expresszióval járt (Mann-Whitney, P=0,0014).
KÖVETKEZTETÉS: Az eredményeink alapján megállapítható, hogy a 99mTc-EDDA/HYNIC-TOC SPECT/CT alkalmas a neuroendokrin tumorok és a karcinómák megkülönböztetésére. Vizsgálatunk alapján a CK7, TTF-1 és CEA negativitás jó prognosztikai tényezőként előre jelezheti a magas szomatosztatin receptor expressziót. Az adatok ilyen típusú komplex, személyre szabott kiértékelése fontos szerepet játszhat a neuroendokrin tumorok biokémiai viselkedésének további megértésében és a PRRT-re alkalmas betegek optimális kiválasztásában.
2. A 99mTc-I&S PSMA SPECT/CT diagnosztikus paraméterei a primer prosztatarákban és biokémiai relapszusban
Farkas István, Sipka Gábor, Bakos Annamária, Czékus Tamás Mikó Zsófia, Német Rita, Besenyi Zsuzsanna, Pávics László
SZTE – ÁOK Nukleáris Medicina Intézet, Szeged
Az elmúlt évtized során az egyre szélesebb körben elterjedő kis molekulájú PSMA ligandok forradalmasították a prosztatarák nukleáris medicinai diagnosztikáját és terápiáját. Folyamatosan növekvő számú és egyre robosztusabb evidenciák sora bizonyítja, hogy a PSMA-PET/CT egyaránt kiválóan használható a prosztatarákos betegek esetén a stádium meghatározásra, valamint a betegség kiújulásának vagy progressziójának esetén is. Azonban lényegesen kevesebb információ áll rendelkezésünkre a 99mTc-mal jelölhető ligandokkal, illetve a PSMA alapú SPECT/CT-vel. A vizsgálat célja a 99mTc-PSMA-SPECT/CT diagnosztikus paramétereinek meghatározása volt prosztatarákban.
Hét egészséges önkéntes és 100 prosztatarákos férfi beteg PSMA-SPECT/CT vizsgálatát elemeztük retrospektív módon. Közülük 28 beteget szövettanilag igazolt magas rizikójú primer prostatcarcinoma, 72 beteget pedig biokémiai relapszus vagy a stabil betegség progressziója miatt vizsgáltunk. A radiofarmakon intravénás beadását követően 6 órával egésztest SPECT/CT-felvételeket készítettünk. A képeket vizuálisan és szemi-kvantitatív módon is értékeltük.
Primer prostatacarcinoma esetében szenzitivitás, specificitás, pozitív prediktív érték, negatív prediktív érték és pontosság 86%, 100%, 100%, 100%, 64% és 89% volt. Ugyanezen paramétereket az áttétek kimutatására 88%, 100%, 100%, 100%, 83% és 93%-nak találtuk. A primer prosztatarák radiofarmakonfelvétele szignifikánsan magasabbnak bizonyult az egészséges prosztata szövetben mérhetőnél. Biokémiai relapszus esetén a lokális recidíva kimutatását illetően a szenzitivitás, specificitás, pozitív prediktív érték, negatív prediktív érték és pontosság 67%, 100%, 100%, 100%, 86% és 89%, az áttétek kimutatását illetően pedig 91%, 94%, 98%, 79% és 92% volt. A restaging céljából vizsgált betegek esetében a teszt pozitivitási arány a 1 ng/ml PSA szint alatt 37%, 1-5 ng/ml között 74%, 5 ng/ml feletti érék esetén és 80% volt.
Tapasztalataink szerint 99mTc-PSMA-I&S-SPECT/CT könnyen beilleszthető a rutin diagnosztikai gyakorlatba, és értékes diagnosztikai információkat nyújt mind a prosztatarák elsődleges stádiumbeosztásában, mind a betegség kiújulása és progressziója esetén.
3. Kezdeti tapasztalatok 18F-JK-PSMA-7 PET/CT vizsgálattal prostata adenocarcinoma biokémiai relapsusában
Nádasdy-Horváth Domonkos1, Czibor Sándor1,2, Jánosa Cintia Barbara1, Kiss Eszter1, Albert Orsolya1, Barra Magdolna1, Varga Zsolt1, Tóth Gyula2, Szakáll Szabolcs2, Szalontai János3, Szűcs Miklós3, Nyirády Péter3, Györke Tamás1
1Semmelweis Egyetem Orvosi Képalkotó Klinika Nukleáris Medicina Tanszék, Budapest
2Pozitron-Diagnosztika Központ, Budapest
3Semmelweis Egyetem Urológiai Klinika, Budapest
Bevezetés: Magyarországon a férfiak második leggyakoribb daganat típusa a prostatarák, mely az ötödik vezető halálok is egyben. A radikális műtéten vagy definitív prostata-irradiatión, illetve kiegészítő sugár- és/vagy hormonterápián átesettek egyharmadánál a betegség kiújul 10 éven belül. A primer definitív terápia utáni biokémiai relapsus esetén a prostata-specifikus membránantigén (PSMA)-alapú molekuláris képalkotás a jelenlegi legérzékenyebb vizsgálat a daganat kiújulásának igazolásában és a recidíva lokalizálásában, mely a klinikai döntéshozatalt is jelentősen befolyásolja.
Anyag és módszer: Retrospektív elemzést végeztünk a Semmelweis Egyetem Urológiai Klinika 30 olyan betegének adatain, akiknek 2021 júliusa és 2022 februárja között készült 18F-JK-PSMA-7 PET/CT vizsgálata definitív ellátás (radikális prostatectomia, esetleges kiegészítő hormon- és/vagy sugárterápia) utáni biokémiai relapsus (total szérum prostata-specifikus antigén [PSA] emelkedés) miatt. A PET/CT felvételeket lokális recidíva, nyirokcsomó-metasztázisok és távoli metasztázisok jelenléte szerint értékeltük, és szemikvantitatív méréseket végeztünk az EARL-szabvány szerint rekonstruált PET-felvételeken. A betegeket két-két alcsoportra osztottuk a vizsgálat előtti PSA-szint és PSA duplázódási idő (PSAdt) szerint. A teljes betegcsoporton, illetve a fenti alkategóriák mentén detekciós arányt (DR) számítottunk, valamint pozitív vizsgálati eredmény esetén megvizsgáltuk, hogy van-e összefüggés a legintenzívebb laesiok maximális standardizált felvételi értéke (SUVmax) és a PSA-szint vagy a PSAdt érték között.
Eredmények: A 30 vizsgált beteg közül 23 páciensnél ábrázolódott prostatacarcinomának megfeleltethető PSMA-avid laesio, mely alapján a betegenkénti DR 76,7%-osnak adódott. A kóros PSMA-avid laesiók leggyakrabban a prostataágyban (11) és kismedencei nyirokcsomókban (10) ábrázolódtak, ugyanakkor extrapelvicus nyirokcsomókban (5), csontokban (8) és egyéb szervekben (4) is előfordultak az alapbetegség kiújulásával összefüggésbe hozható dúsulások. Az alcsoportonkénti DR a következőképpen alakult: PSA<1 ng/ml: 53,9% vs. PSA>1 ng/ml: 94,1% (p=0,025); illetve PSAdt≤6 hónap: 81,3% vs. PSAdt>6 hónap: 71,4% (p=NS). A PSMA-pozitivitást mutató betegeknél a legintenzívebb laesio SUVmax értéke szignifikánsan magasabb volt a PSA>1 ng/ml csoportban, mint a PSA<1 ng/ml PSA-értékű betegeknél (32,6 +- 31,6 vs. 12,7 +- 7,9; p=0,03). Hasonlóképp, a 6 hónapnál rövidebb PSAdt-jű betegek felvételein is magasabb SUVmax értékek voltak mérhetőek, mint a mérsékeltebb dinamikájú PSA-duplázódást mutató páciensekén (36,6 +- 34 vs. 13,4 +- 5,9; p=0,02).
Következtetés: A PSMA PET/CT érzékeny vizsgálómódszer a recidív prostatacarcinomák kimutatásában és lokalizálásában, melynek detekciós rátája 1 ng/ml feletti PSA-szint és/vagy rövid PSAdt esetén a legmagasabb, az irodalmi adatokkal összhangban.
4. 18F-DOPA PET/CT szerepe a központi idegrendszere daganatok kezelésében
Kelemen Gyöngyi1, Besenyi Zsuzsanna2, Pávics László2, Cserháti Adrienn1, Együd Zsófia1, Dobi Ágnes1, Tóth Rozália1, Oláh Judit1, Hideghéty Katalin1
Szegedi Tudományegyetem, Általános Orvostudományi Kar, 1Onkoterápiás Klinika, 2Nukleáris Medicina Intézet, Szeged
Célkitűzés: Célul tűztük ki 18F-DOPA PET/CT vizsgálatok prelimináris értékelését az adekvát onkológiai döntés támogatásában és az individuális sugárkezelésben.
Módszer: A központi idegrendszeri daganatos betegségek diagnosztikájában a konvencionális képalkotó vizsgálatok (MR) mellett idén bevezettük az aminosav bázisú 18F-DOPA PET/CT vizsgálatot, az agyi térfoglaló folyamatok kiújulásának megítélésére, illetve a sugárkezelési céltérfogat pontosítására. A vizsgált betegek eddigi eredményeit dolgoztuk föl.
Eredmények: Klinikánkon 2021. január és 2021. május között 21 betegnél történt 18F-DOPA PET/CT vizsgálat; 2 betegnél oligodendroglioma, 3 betegnél astrocytoma, 16 betegnél glioblastoma alapdiagnózissal. A betegek átlag életkora 41,18 év volt. 12 esetben igazolódott fokozott F-DOPA felvétel, míg 9 esetben negatív eredményt kaptunk. A negativitás 8 betegnél a további MR követés alapján is igazolódott, ebből 3 betegnél a felfüggesztett antitumorális kezelés mellett is (5-6 hónapja). 1 beteg glioblastomája 6 héttel a vizsgálat után recidivált, és rapidan progrediál. 6 esetben negatív vagy bizonytalan MRI lelet mellett jelzett progressziót, a további 6 pozitiv DOPA PET megerősítette az MR-en is észlelt elváltozás viabilis tumor jellegét (szemben a fölmerült radionecrosissal), ill. postoperatív reziduális tumor jelenlétét igazolta. A fentiek közül 6 betegnél történt a vizsgálat a sugárterápia tervezése előtt, mely a kóros F-DOPA halmozású esetekben (4/6) jelentősen támogatta a végleges céltérfogatok (GTV-PTV) meghatározását.
Következtetések: Prelimináris adataink alapján megállapítható ezen vizsgálat fontossága a terápiás döntésben, valamint a 18F-DOPA PET/CT jól alkalmazható a sugárkezelés tervezésében: jelentősen támogatja a műtét utáni reziduum megítélését, hozzájárulhat a céltérfogat pontosításához, illetve recidíva esetén a reirradált céltérfogat kijelöléséhez.
5. Tapasztalataink gliomás betegeken végzett dinamikus 18F-DOPA PET/CT-vel recidív tumoros folyamat kimutatására
Mikó Zsófia1, Sipka Gábor1, Urbán Szabolcs1, Bakos Annamária1, Nagy Szanella1, Farkas István1, Czékus Tamás1, Hideghéty Katalin2, Pávics László1, Besenyi Zsuzsanna1
1SZTE Szent-Györgyi Albert Klinikai Központ, Nukleáris Medicina Intézet, Szeged
2 SZTE Szent-Györgyi Albert Klinikai Központ, Onkoterápiás Klinika, Szeged
Bevezetés: A neuroonkológiai klinikai gyakorlatban a radiofarmakonnal jelölt aminosav alapú PET/CT vizsgálatok a gliomák diagnosztikájának szerves részét képezik a „gold standardként” alkalmazott kontrasztos MRI vizsgálat mellett. Szakirodalmi adatok alapján az 18F-DOPA PET/CT többletinformációt nyújthat a gliomák grádusának meghatározásában, a kiterjedésük pontosabb megítélésében, a recidíva és a terápia indukált elváltozások elkülönítésében, a terápiás válasz megítélésében, illetve alacsony grádusú gliomáknál a betegség prognózisának megjóslásában. Jelen vizsgálatunk célja a 18F-DOPA PET/CT során nyert dinamikus paraméterek vizsgálata recidív folyamat kimutatásában.
Módszerek: Kutatásunkba retrospektíven 27 beteget (16 férfi és 11 nő, átlagéletkor diagnóziskor 44,9 év) vontunk be. Beválogatási kritériumaink: glioma miatti műtét a korábbi anamnézisében, kóros radiofarmakon akkumuláció intracranialisan az elvégzett 18F-DOPA PET/CT vizsgálat vizuális értékelése során. A vizsgálat pozitív eredményét a neuro-onkológiai statusban bekövetkező változás, a kontroll koponya MR, illetve a reoperációkor nyert szövettani eredmény igazolta.
A vizsgálat során korai dinamikus leképezés történt, majd a radiofarmakon beadását követően 60-90 perccel késői PET vizsgálat készült natív low-dose CT-vel kiegészítve.
A striatum, a szürkeállomány és a kisagy kijelölése kézzel, a lézió kijelölése korai felvételeken automatikus küszöbérték alapján, szükség esetén manuális javítással történt.
A PET felvételeken statikus paramétereket határoztunk meg (lézió SUVmax/mean, lézióval ellenoldali striatum és szürkeállomány SUVmax/mean, és kisagy SUVmax/mean). Emellett dinamikus görbeparamétereket határoztunk meg a lézióra és az ellenoldali striatumra illesztett idő-aktivitás görbe alapján. Vizsgáltuk a fenti adatok összefüggését az alkalmazott onkológiai terápiával (műtét, radioterápia, temozolomid terápia), a primer daganat szövettani tulajdonságaival és immunhisztokémiai jellemzőivel. Ez utóbbi klinikai jelentőségét az adja, hogy a központi idegrendszeri daganatok WHO klasszifikációjának alapját 2016 óta az IDH (izocitrát dehidrogenáz) mutációs státusz, valamint a 1p/19q co-deléció jelenléte adja.
Eredmények: A kutatásba bevont 27 beteg intracraniumában összesen 33 léziót detektáltunk. A primer szövettani diagnózis az esetek döntő többségében (19/27) glioblastoma volt. A detektált léziók statikus paraméterei (SUVmax, SUVmean) a vártnak megfelelően szignifikánsan különböztek a kisagy, a lézióval ellenoldali hemispherium és striatum statikus paramétereitől (Mann-Whitney, P<0,0001). A lézióra illesztett görbe meredeksége, Tmax és T ½ értéke is szignifikáns eltérést mutatott a lézióval ellenoldali striatumra illesztett görbe paramétereitől (Mann-Whitney, P<0,0001).
A primer tumorok immunhisztokémiai jellemzői közül az IDH negativitás szignifikánsan rövidebb Tmax-al (Mann-Whitney, P=0,0273) és T1/2-el (Mann-Whitney, P=0,0249) járt.
Következtetés:Az operált gliomás betegek PET/CT vizsgálata 18F-DOPA-val hatékony módszer a recidív tumoros folyamatok kimutatására. A statikus paraméterek mellett a dinamikus vizsgálat során nyert adatok hasonlóan jó pontossággal jelzik a malignus folyamat jelenlétét. A dinamikus leképezés során nyert adatok alapján összefüggést találtunk az IDH mutációs státusz és a görbeparaméterek között, melynek tisztázására további vizsgálatok szükségesek.
6. Tapasztalataink 18F-fluorokolin PET/CT vizsgálattal mellékpajzsmirigy adenoma kimutatására
Jánosa Cintia Barbara1, Kiss Eszter1, Albert Orsolya1, Vaszilkó Éva1, Czibor Sándor1, Bártfai Katalin1, Barra Magdolna1, Bús Katalin1, Varga Zsolt1, Horányi János2, Szlávik Rezső2, Györke Tamás1
1Semmelweis Egyetem Orvosi Képalkotó Klinika Nukleáris Medicina Tanszék, Budapest
2Semmelweis Egyetem Sebészeti, Transzplantációs és Gasztroenterológiai Klinika, Budapest
BEVEZETÉS: A primer hyperparathyreosis gyakori endokrin betegség, amelynek hátterében legtöbbször mellékpajzsmirigy adenoma áll. Tünetes betegség esetén, illetve egyes aszimptomatikus esetekben is műtéti megoldás indokolt, mely solitaer, egyértelműen lokalizált adenoma esetén minimálisan invazív parathyreoidectomia lehet. Az adenoma műtét előtti lokalizálására jelenleg a klinikai gyakorlatban használt rutin eljárás a 99mTc-sestamibi szcintigráfia, azonban irodalmi adatok alapján a 18F-fluorokolin PET/CT szenzitívebb vizsgálómódszer lehet.
ANYAG ÉS MÓDSZER: 2021 májusa és 2022 márciusa között 20 olyan, hyperparathyreosisban (19 esetben primer hyperparathyreosisban és 1 esetben secundaer hyperparathyreosisban) szenvedő beteget vizsgáltunk 18F-fluorokolin PET/CT vizsgálattal, akiknél a 99mTc-sestamibi szcintigráfia negatív, illetve bizonytalan eredményt mutatott. A PET/CT eredményeket a későbbiekben műtétre került betegek szövettani diagnózisával vetettük össze.
EREDMÉNYEK: A 20 vizsgált beteg közül a 18F-fluorokolin PET/CT 13 esetben pozitív lett (12 esetben adenomára, illetve a secundaer hyperparathyreosisban szenvedő beteg esetében multiplex hyperplasiára utalt); 5 esetben negatív és 2 esetben bizonytalan eredményt mutatott. A 12 PET/CT pozitív, adenomának tartott eset közül az absztrakt elkészítéséig 8 beteg esett át operáción, mely során a PET/CT-vel lokalizált képletek eltávolításra kerültek és a szövettani feldolgozásából minden esetben igazolódott a mellékpajzsmirigy adenoma. A PET/CT negatív esetek közül 1 betegnél került sor műtéti megoldásra, mely során szintén egy adenoma sikeres eltávolítása történt. A műtétet követően minden beteg parathormon és kalcium szintje a felső határérték alá csökkent.
KÖVETKEZTETÉS: A 18F-fluorokolin PET/CT segítséget nyújt a hagyományos, 99mTc-sestamibi szcintigráfiával nem, illetve nem egyértelműen azonosítható adenomák preoperatív lokalizálásában, ezzel a műtét sikerességét növelve és kisebb műtéti kockázatot lehetővé téve.
7. Mellékpajzsmirigy adenoma lokalizációs indikációjú multimodális 18F-Kolin PET vizsgálatokkal szerzett kezdeti tapasztalatok
Tóth Zoltán1, Horváth Gyula1,2, Kisiván Tímea1, Takács Alíz1, Farkas Andrea2, Fajtai Dániel1, Emri Miklós1,3, Barna Sándor4, Nagy Endre5, Bajnok László6, Repa Imre2
1Medicopus Egészségügyi Szolgáltató Közhasznú Nonprofit Kft., Kaposvár
2Dr. Baka József Diagnosztikai, Onkoradiológiai, Kutatási és Oktatási Központ, Kaposvár
3Debreceni Egyetem KK, Orvosi Képalkotó Klinika, Nukleáris Medicina Nem Önálló Tanszék, Debrecen
4ScanoMed Orvosi, Diagnosztikai, Kutató és Oktató Kft, Debrecen
5Debreceni Egyetem KK, Belgyógyászati Klinika, Endokrinológiai Tanszék, Debrecen
6Pécsi Tudományegyetem KK, I. sz. Belgyógyászati Klinika, Pécs
Bevezetés: Jelen felmérésünkben a multimodális 18F-Kolin PET vizsgálat alkalmazását értékeltük mellékpajzsmirigy adenoma lokalizációs indikációban, sikertelen vagy bizonytalan eredményű konvencionális képalkotást követően, valamint az eredményeinket összevetettük a nemzetközi irodalomban elérhető adatokkal.
Anyag és módszer: Retrospektív felmérésünkben 37 hyperparathyreosis miatt vizsgált páciens (24 nő, 13 férfi; átlag életkor: 47 év; serum Ca: 2,3-3 mmol/l; serum PTH: 63-455 ng/ml) adatait dolgoztuk fel. 34 esetben primer-, 3 esetben tercier hyperparathyreosis iránydiagnózis miatt történt mellékpajzsmirigy adenoma lokalizációs célú vizsgálat, negatív vagy inkonkluzív eredményű konvencionális képalkotást követően. 19 betegnél PET/MR, 16 páciensnél PET/CT vizsgálat történt, 2 esetben mindkét beavatkozás elvégzésre került. 2 MBq/ttk 18F-Kolin intravénás beadása után 10 illetve 60 perccel végeztünk multimodális leképezést a koponyabázistól a rekeszig. A képeket vizuálisan értékeltük, PET pozitív és PET negatív csoportot különítettünk el. A páciensek serum Ca és PTH értékeinek a lokalizációs vizsgálat eredményességével való kapcsolatát szintén elemeztük.
Eredmények: 27 betegnél (73%) találtunk mellékpajzsmirigy adenomára utaló 18F-Kolint halmozó elváltozást, 4 esetben (11%) két adenomának megfelelő farmakont dúsító eltérés is ábrázolódott. 10 páciensnél a vizsgálat negatívnak bizonyult. A műtéti, szövettani eredmények begyűjtése, feldolgozása folyamatban van. A betegek serum Ca és PTH értékei, illetve a lokalizációs vizsgálat eredményessége között nem találtunk statisztikailag szignifikáns összefüggést (Student-T teszt, p = 0.287 ill. p = 0.456).
Következtetés: A multimodális 18F-Kolin PET vizsgálat a nemzetközi irodalmi adatok, illetve a kezdeti tapasztalataink alapján ígéretes újszerű módszernek tűnik mellékpajzsmirigy adenoma preoperatív lokalizációs diagnosztikája során, a konvencionális képalkotó eljárások sikertelensége, illetve bizonytalan eredménye esetén.
8. COVID-19 betegség vizsgálata és követése agyi PET/CT vizsgálattal
Száraz Lili1, Czibor Sándor2, Simon Judit3, Zsarnóczay Emese3, Kiss Fanni Júlia2, Dombai Brigitta4, Müller Veronika4, Maurovich-Horvat Pál3, Györke Tamás2
1Semmelweis Egyetem, Általános Orvostudományi Kar, Budapest
2Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
3Semmelweis Egyetem, Orvosi Képalkotó Klinika, Radiológiai Tanszék, Budapest
4Semmelweis Egyetem, Pulmonológiai Klinika, Budapest
Bevezetés: A COVID-19 betegség a SARS-CoV-2 vírus által okozott légúti fertőzés, multiszisztémás, gyulladásos tünetekkel társulva. A központi idegrendszeri tünetek értékelésében a PET/CT funkcionális képalkotó vizsgálatként többletinformációt adhat a késői szövődmények vonatkozásában. Kutatásunk célja volt a Semmelweis Egyetem Orvosi Képalkotó Klinika Nukleáris Medicina Tanszékén végzett agyi FDG-PET/CT vizsgálatok értékelése aktív koronavírus-fertőzött betegekben, illetve az eredmények összevetése három hónapos kontroll vizsgálatukkal.
Anyag és módszer: Egycentrumos, prospektív kutatásunkban résztvevő betegekről agyi PET/CT felvételek készültek az aktív fertőzéses stádiumban, valamint három hónappal később. A képanyag kiértékelése a GE Cortex ID szoftver segítségével történt, mely a különböző kortikális régiók metabolikus aktivitását normál adatbázishoz viszonyítja. Az így kapott eredmények közül a Z-score értékeket használtuk az elemzéshez. Az egyes agyi területek értékeit összesítettük, illetve különböző Z-score vágópontokat kijelölve (-2; -1,5; -1) kategorizáltuk megtartott és csökkent funkció szerint. Jelen vizsgálatban 36 beteg vett részt (14 nő, 22 férfi), átlag életkoruk 52 év volt (42-75 év).
Eredmények: Az infektív szakaszban készült felvételeken a betegek többségében diffúz, szignifikáns korikális hypometabolizmus volt észlelhető, mely a kontroll felvételeken nagyarányú (-2-es Z-score vágópont mentén a betegek több mint 90%-ában megfigyelhető) normalizálódást mutatott. A leggyakoribb reziduális hypometabolizmust mutató területek a medialis prefrontalis és temporalis régiók, illetve az anterior cingulum voltak, valamint ezen területeken volt megfigyelhető a legalacsonyabb arányú normalizálódás.
Következtetés: A vizsgált kohorszban észlelt reziduális kortikális hypometabolikus eltérések korrelálnak a témában született tudományos közlések tartalmával, tehát a COVID-19 betegségnek feltehetőleg hosszútávú hypometabolikus maradványtünetei vannak az agyban, kifejezetten a szaglóközpontban, az orbitofrontalis kérgi területeken, illetve a limbikus rendszer egyes részeiben. Azonban, a kutatás limitáló tényezője, hogy a betegek az első felvétel ideje alatt már korikoszteroid-terápiában részesültek, mely a diffúz hypometabolizmust magyarázhatja, továbbá, a COVID-19 betegség előtti agyműködésükről sincsenek PET-adataink.
9. Szokatlan perfúziós mintázat COVID-19 fertőzött betegek tüdőszcintigráfiás perfúziós SPECT/CT felvételein
Farkas Bence1,2, Képes Zita1,2, Bakos Magdolna3, Szugyiczki Viktória3, Forgács Attila1, Barna Sándor1, Garai Ildikó1,2
1 ScanoMed Kft. Nukleáris Medicina Központ, Debrecen
2 Debreceni Egyetem, Diagnosztikai Egységek, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Debrecen
3Békés Megyei Központi Kórház, Nukleáris Medicina Osztály, Gyula
Bevezetés (Background): Kevés tanulmány áll rendelkezésre, mely a COVID-19 fertőzött betegek perfúziós SPECT/CT (Q-SPECT/CT) felvételeinek elemzésével foglalkozik. Ezért vizsgálatunk során célunk volt felmérni a különféle tüdőperfúziós rendellenességek incidenciáját és súlyosságát, valamint a közöttük fennálló kapcsolatokat COVID-19 fertőzött betegeken végzett Tc99m-mal jelzett makroaggregált albumin (Tc99m-MAA) Q-SPECT/CT felvételeken.
Anyag és módszer (Methods): Kilencvenegy, valós idejű polimeráz láncreakcióval igazolt SARS-CoV-2 vírusfertőzésben szenvedő beteget vontunk be retrospektív vizsgálatunkba. A Tc99m-MAA Q-SPECT/CT felvételek elvégzését követően az alacsony dózisú CT-felvételeken ábrázolódó parenchymás érintettség, valamint az alábbi perfúziós rendellenességek vizuális, félkvantitatív elemzését végeztünk el: 1. mismatch léziók (csökkent perfúziójú, ép morfológiájú tüdőterületek); 2. matched léziók (csökkent perfúziójú parenchymás elváltozások); 3. fordított mismatch léziók (megtartott vagy fokozott perfúziójú parenchymás eltérések). Lézió- és beteg-alapú értékeléssel becsültük meg az egyes perfúziós rendellenességek kiterjedését, súlyosságát és előfordulási gyakoriságát. Majd statisztikai teszteket alkalmaztunk a tapasztalt perfúziós defektusok közötti összefüggések vizsgálatára.
Eredmények (Results): Mérsékelten-közepesen súlyos parenchymális elváltozásokat találtunk 87 (95,6%) betegnél. Habár, 50 (54,95%) betegnél figyelhettünk meg mismatch léziókat, a teljes betegcsoport tekintetében ezen eltérés enyhe érintettséget mutatott. A betegek többségénél közepesen súlyos matched léziók voltak láthatóak (89,01%). 65 beteg esetében (71,43%) átlagosan enyhe súlyosságú fordított mismatch léziókat találtunk. Pozitív korreláció volt detektálható a „CT-pontszám” és „fordított mismatch-pontszám” között, valamint a „CT-pontszám” és a „matched-pontszám” között. Szignifikánsan magasabb CT-pontszám értékeket tapasztaltunk azon alcsoportban, ahol fordított mismatch léziók is jelen voltak.
Következtetés (Conclusion): A legtöbb COVID-19 fertőzött beteg esetében heterogén perfúziós abnormalitásokat találtunk: parenchymalis eltéréseket figyelhettünk meg normál, csökkent és fokozott perfúzió mellett, illetve perfúziós defektusokat ép morfológiájú tüdőterületeken. Ezen jelenségek a hypoxiás pulmonalis vasoconstrictios mechanizmus működésének rendellenességével, valamint pulmonalis trombózis és embólia jelenlétével magyarázhatóak.
10. A COVID-19 megbetegedés és COVID-oltás utáni kardiális panaszok háttere a szívizom szcintigráfia tükrében
Jóba Róbert Péter, Moravszki Mónika, Buga Klára
Magyar Honvédség Egészségügyi Központ, Nukleáris Medicina Osztály, Budapest
Bevezetés: A COVID-19 megbetegedés tipikus tünetei, a láz, köhögés, torokfájás, fáradtság, fájdalom és nehézlégzés. A mellkasi fájdalom csak néhány COVID-19-betegnél fordul elő, de a fáradékonysággal, nehézlégzéssel és a terhelhetőség csökkenéssel a post-COVID szindróma jellemző tünete. Egyes COVID-19-en át nem esett betegeknél viszont vakcináció után jelentkeznek hasonló tünetek. A közepes rizikócsoportba tartozó betegeknél a diagnosztikus algoritmus alapján szívizom szcintigráfia kerül elvégzésre.
Anyag és módszer: Intézményünkben 138 betegnél terheléses és nyugalmi szívizom szcintigráfia történt. 8 beteg korábban bizonyítottan COVID-19 pozitív volt, 2 beteg a vakcina beadása után jelentkező panaszok miatt került vizsgálatra. A SPECT vizsgálatokat egy napos protokoll („stressfirst”) alapján, GE Infinia készülékkel végeztük.
Eredmények: A 6 korábban COVID-19-en átesett betegnél és 2 COVID-19 oltást kapott betegnél szignifikáns aktivitáscsökkenés nem ábrázolódott. 2 betegnél szignifikáns irreverzibilis aktivitáscsökkenés volt megfigyelhető. (Az egyik beteg korábbi myocardialis infarctusos előzményekkel rendelkezett, a másik beteg testtömege és az aktivitáscsökkenés diffúz-sávszerű jellege alapján, az aktivitáscsökkenés hátterében rekesz okozta attenuáció valószínűsíthető). Az anamnesztikus adatok alapján COVID 19-en át nem esett betegeknél: 26 betegnél szignifikáns, 3 betegnél szubszignifikáns irreverzibilis aktivitáscsökkenés volt megfigyelhető (az irreverzibilis aktivitáscsökkenés hátterében 2 betegnél bal Tawara szár blokk, 8 betegnél teljesen, egy betegnél részben rekesz okozta attenuáció is magyarázhatta az eltérést). 10 betegnél szignifikáns, 12 esetben szubszignifikáns reverzibilis aktivitáscsökkenés ábrázolódott. 4 betegnél szignifikáns reverzibilis és irreverzibilis aktivitáscsökkenés is látható volt.
Következtetés: A 8 COVID-19 fertőzésen átesett, és 2 COVID-19 ellen oltott panaszos betegek száma a betegeségen át nem esett 128 beteghez képest túl alacsony, hogy teljes értékű következtetéseket vonhassunk le; a rendelkezésre álló adatok alapján úgy tűnik, hogy a COVID-19 fertőzés önmagában a terheléses és nyugalmi perfúziós szívizom szcintigráfia alapján a -betegség lezajlása után a post COVID tünetegyüttes részeként- nem növeli koronária intervenciót igénylő perfúziós zavarok előfordulási gyakoriságát.
11. CT-morfológiai és PET-metabolikus paraméterek összehasonlítása COVID-19 pneumoniában
Czibor Sándor1, Száraz Lili2, Simon Judit3, Zsarnóczay Emese3, Dombai Brigitta4, Kiss Fanni Júlia1, Albert Orsolya1, Kiss Eszter1, Szoó Anett1, Müller Veronika4, Maurovich-Horvat Pál3, Györke Tamás1
1Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
2Semmelweis Egyetem, Általános Orvosi Kar, Budapest
3Semmelweis Egyetem, Orvosi Képalkotó Klinika, Radiológiai Tanszék, Budapest
4Semmelweis Egyetem, Pulmonológiai Klinika, Budapest
Bevezetés: A koronavírus megbetegedés (COVID-19) kritikus állapotot okozó patomechanizmusában kiemelkedő helyen áll a tüdőgyulladás. A 18F-fluoro-dezoxi-glükóz Pozitron Emissziós Tomográfia és Computer Tomográfia (FDG-PET/CT), mint hibrid képalkotó modalitás a tüdőt érintő morfológiai elváltozások mellett a metabolizmusról is információt ad, így additív információt szolgáltat a gyulladás aktivitásának és kiterjedésének tekintetében. Kutatásunk célja volt a laboratóriumi és CT-morfológiai eltérések illetve a PET felvételen detektált metabolikus paraméterek összefüggésének vizsgálata.
Anyag és módszer: Egycentrumos, prospektív kutatásunkban COVID-19 miatt hospitalizált felnőtt betegeket vizsgáltunk, akiknél protokoll szerint kórházi felvételkor CT, majd kontrollként PET/CT-vizsgálat történt. Szoftveres méréssel meghatároztuk a tüdőben levő CT-morfológiai és PET-metabolikus (metabolikus inflammatorikus volumen, MIV) eltérések kiterjedését. A baseline és kontroll vizsgálatok időpontjában felvett laboratóriumi és CT-paraméterek MIV-vel szembeni Spearman-korrelációs r-értékei alapján logisztikai regressziós modelleket készítettünk, illetve ezeket Receiver Operating Characteristics analízissel is elemeztük. Összesen 44 beteg adatát vizsgáltuk, közülük 25 volt férfi és átlagéletkoruk 52 év (41-78 év) volt.
Eredmények: A MIV medián értéke 209 ml volt (1-1797 ml). A MIV-szegmentáció magas reprodukálhatóságot mutatott (osztályon belüli korrelációs együttható, ICC=0,995). A baseline tejüveghomály (GGO%, r=0,36) és CT súlyossági pont (r=0,39) gyenge, míg a kontroll CT-felvételen mért összes tüdőeltérés százalékos értéke (r=0,77) erős korrelációt mutatott a MIV értékével. A kórházi felvétel adatait tartalmazó Modell 1 (GGO% és IL-6) és Modell 2 (GGO% és CT súlyossági pont) gyenge összefüggést adott a MIV értékével (AUC=0,59 és AUC=0,69), míg a kontroll hibrid képalkotó vizsgálat CT komponensén mért összes tüdőeltérés százalékos értékét, illetve a kontroll IL-6 és LDH szinteket tartalmazó Modell 3 esetén magasabb prediktivitást találtunk (AUC=0,88).
Következtetés: A baseline paramétereket tartalmazó Modell 1 és 2 kevésbé bizonyult prediktívnek a MIV vonatkozásában, mint a kontroll képalkotás során felvett paraméterek tartalmazó Modell 3. Ezek mentén, a kórházi felvétel után egy héttel végzett CT és laboratóriumi paraméterek kombinált értékelése a tüdő aktuális gyulladásos státuszát jól reprezentálja COVID-19-ben.
2022. május 19. csütörtök, 14:00 – 16:00, Asszisztens továbbképzés
1. Új irányvonalak az izotópterápia területén
Nagy Gábor
ScanoMed Kft. Debrecen
Világszerte, az egészségügy számos területén egyre szélesebb körben alkalmaznak radioizotópokat különböző célzott és személyre szabott terápiás kezelésekhez. Magyarországon a klasszikusnak tekinthető [131I]-NaI pajzsmirigy terápián kívül csak a palliatív célú, életminőséget javító izotópterápiás eljárások folynak. Ilyen például a csont metasztázisoknál alkalmazott, fájdalom csökkentésére szolgáló 223RaCl2 és 153Sm/111In-EDTMP, vagy az ízületi folyadék túltermelődését kezelő eljárás során használt 166Ho- és 90Y-jelölt kolloidok. Hazánkban számos klinikai szakterületen mutatkozik nagy igény egyéb, specifikus és a modern radioizotóp terápia területén zászlóshajóként számon tartott radiofarmakon bevezetésére és felhasználására. Az előadás során olyan készítmények és radioizotópok ismertetésére kerül sor, amelyek a közeljövőben rutin terápiás szerekké válhatnak különböző betegségek kezelésében.
Ezen túl kiemelésre kerülnek a diagnosztikát és terápiát ötvöző, úgynevezett teranosztikus radioizotóp párok és azok alkalmazási területei is.
2. 18F-Kolin PET/CT alkalmazása prosztata tumoros betegcsoportban
Tóth Zoltán
Medicopus Egészségügyi Szolgáltató Közhasznú Nonprofit Kft., Kaposvár
A tüdő tumorok mellett a prosztata malignus daganatai okozzák a férfiak leggyakrabban előforduló rosszindulatú rákos megbetegedéseit. Mint minden más neoplázia esetén a precíz kezelés előtti stádiumfelmérés, illetve a betegség kiújulásának korai kimutatása alapvető fontosságú az optimális kezelési stratégia meghatározásához. Az onkológiai diagnosztikában leggyakrabban alkalmazott FDG PET radiofarmakon csupán a prosztata tumorok kis részét kitevő agresszív betegségcsoportban használható eredményesen, a többi prosztata tumor esetén gyakran álnegatív eredménnyel jár, korlátozott értékű, ezért általában egyéb radiofarmakon alkalmazása szükséges prosztata tumoros indikációjú PET vizsgálatokhoz.
A kolin a sejtmembrán foszfolipid komponensének esszenciális építő eleme. Sejtosztódáshoz, új sejtmembrán elemek képzése, kolin jelenléte szükséges. Fokozott sejtmembrán képződéssel, fokozott sejtosztódással járó folyamatok radioaktívan jelzett kolin farmakonokkal izotópdiagnosztikai módszerekkel detektálhatók. A kolin alapú radiofarmakonok magas affinitással kötődnek a fokozott sejtmembrán szintézissel járó malignus prosztata tumoros szövetekben. C11 valamint F18 izotóppal jelzett kolin PET radiofarmakonok napjainkra egyaránt elérhetővé váltak Magyarországon. Míg a C11 izotópot tartalmazó radiofarmakon kizárólag az előállítás helyén használható fel, a 18F-Kolin (a hosszabb fizikai felezési idejének köszönhetően) szállítható és ciklotronnal nem rendelkező PET központokban is alkalmazható, továbbá korai és késői leképezési lehetőséget egyaránt biztosít. A radiofarmakon alkalmazásával járó sugárterhelés az FDG-vel végzett diagnosztikai vizsgálatokhoz hasonló.
Humán vizsgálatok során a 18F-Kolin radiofarmakon normál eloszlására jellemző, hogy máj, a lép, a vesék valamint a nyálmirigyek fiziológiásan intenzív farmakon felvétellel ábrázolódnak, a belek valamint a gyomor változó mértékű radiofarmakon felvételt mutatnak, a tracer a vizelettel kiválasztódik és a hugyhólyagban is általában fiziológiásan intenzív vizeletaktivitás detektálható, továbbá a csontvelő mérsékelt-homogén aktivitással ábrázolódik. A prosztata malignus tumoros elváltozásai, valamint az áttétek kóros-körülírt radiofarmakon akkumuláció formájában detektálhatók. Ugyanakkor a 18F-Kolin nem prosztata tumor specifikus radiofarmakon, (az FDG-hez hasonlóan) benignus, gyulladásos és egyéb malignus folyamatokban egyaránt halmozódhat, mely a vizsgálatok értékelését nehezítheti, korlátozhatja. A teljestest Kolin PET/CT vizsgálat a prosztata tumor lokalizációjára, a környező kismedencei szervek érintettségére, nyirokcsomó valamint távoli áttétek jelenlétére vonatkozóan egyetlen vizsgálat elvégzésével információt szolgálhat, illetve kiegészítheti a konvencionális képalkotó módszerek alkalmazását.
A 18F-Kolin PET/CT leggyakoribb és fontosabb klinikai indikációját a gyógyító célú kezelésen átesett betegeknél fellépő kiújulás képzi. A betegség relapszusa gyakori, akár a gyógyító célzatú definitív terápián átesett betegek felét érintheti, melynek első jele általában a követés során használt PSA tumormarker emelkedése. Az optimális kezelés (műtét, sugárterápia vagy gyógyszeres terápia) megválasztása a kiújulás kismedencei-lokális, regionális vagy a szervezet más részét érintő „szisztémás” jellegének függvénye. Az újonnan diagnosztizált prosztata tumoros betegek optimális kezelésének megválasztásában elsősorban a lokálisan előrehaladott, magas rizikó csoportba tartozó, nyirokcsomó áttéttel vagy magas PSA szinttel társuló betegcsoportban lehet előnyös az alkalmazása, a stádium pontosítására. Prosztata tumor gyanú esetén, amennyiben más képalkotó vizsgálattal a daganat nem lokalizálható, valamint a szövettani mintavétel eredménytelen szintén alkalmazható. A terápia eredményességének felmérésére, az egyéb képalkotókkal felfedezett bizonytalan eltérések karakterizálására valamint oligo-metasztázis, oligo-progresszió megállapítására egyaránt alkalmas lehet az eljárás.
3. Gamma kamerás újdonságok a nukleáris medicinában
Barna Sándor Kristóf
ScanoMed Kft. Debrecen
Az utóbbi időben a COVID-19 pandemia alatt úgy tűnhetett, hogy a fejlődés a gamma kamerák vonatkozásában megállt, vagy kisebb vonatkozású dolgok történhettek.
Az elmúlt évek jelentős változásai az új típusú kollimátorok megjelenése, többek között a alacsony energiájú, magas felbontású és érzékenységű kollimátorok megjelenése, mellyel rövidebb képidővel is begyűjthetjünk kiváló minőségű képeket, mint a hagyományos kollimátorokkal. A SPECT begyűjtés egyik hátráltató tényezője a detektormozgás, mely során időt, és begyűjtött afotonokat veszthetünk és növeljük a begyűjtési időt. A folyamatos SPECT elérhetővé vált a legtöbb gyártó kameráink az utóbbi 2-3 évben. A LIST módú adatgyűjtés eddig a PET privilégiuma volt, mely megvetette lábát a gamma kamerák begyűjtő állomásain is. A SPECT/CT kamerák egyik CT fejlesztése a dóziscsökkentés, Iteratív rekonstrukció és a fém artefaktum csökkentés lett. A multipinhole kollimátorokkal célszervek pontosabb, részletgazdagabb, vagy gyorsabb vizsgálata válik lehetővé.
A digitális detektorokkal precizebb képalkotás vállhat valóra. A kvantitatív SPECT már nemcsak egy-két egyetemi labor, hanem a rutin SPECT/CT berendezések egyik alaptulajdonságá vált.
A gamma kamerák fejlődése nem ált meg, folyamatosan bővül, mellyel a páciens komfort, dúziscsökkentés, pontosabb, precizebb leletalkotás vállhat valóra úgy, hogy ezen tulajdonságok közül nem választanunk kell, hanem akár egyszerre vehetjük igénybe.
4. PET/CT vizsgálatok asszisztensi szemmel
Pongrácz Barbara
MH EK Honvédkórház Budapest
Az onkológiai betegek vizsgálatában, utánkövetésében jelentős szerepet játszik az FDG-vel végzett PET/CT vizsgálat. Mivel hazánkban már számos ilyen berendezés található, nagyon fontos, hogy a vizsgálatokat végző technológusok megfelelő szakmai felkészültséggel rendelkezzenek. Előadásomban a PET/CT berendezés működési elvét, valamint az FDG-vel végzett vizsgálatok protokolljait szeretném áttekinteni, nagy hangsúlyt fektetve a vizsgálat különböző fázisainak buktatóira. A protokollok mellett kiemelten fontosnak tartom a sugárvédelmi eljárásokat és mérési lehetőségeket, így ezeket is szeretném ismertetni.
2022. május 19. csütörtök, 16:30 – 18:30, Klinikum II.
1. Texturális paraméterek és gépi tanulás jelentősége a lymphomák diagnosztikájában, prognosztikájában és a terápia nyomonkövetésében
Ritter Zsombor1, Papp László2, Zámbó Katalin1, Tóth Zoltán3, Máthé Domokos4,5, Dezső Dániel1, Budán Ferenc6,7, Pajor László8, Szomor Árpád9, Alizadeh Hussain9, Schmidt Erzsébet1
1PTE KK Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Pécs
2 Medical University of Vienna, Center for Medical Physics and Biomedical Engineering, Bécs
3 Kaposvári Egyetem, Medicopus Egészségügyi Szolgáltató Közhasznú Nonprofit Kft., Kaposvár
4Semmelweis Egyetem ÁOK Biofizikai és Sugárbiológiai Intézet, Budapest
5In Vivo Imaging Advanced Core Facility, Hungarian Centre of Excellence for Molecular Medicine, Budapest
6PTE Transzdiszciplinális Kutatások Intézete, Pécs
7PTE ÁOK Élettani Intézet, Pécs
8PTE KK Pathológiai Intézet, Pécs
9PTE KK I. sz. Belgyógyászati Klinika, Hematológiai Tanszék, Pécs
Bevezetés: A diffúz nagy B-sejtes limfóma (DLBCL) B-limfocitákból kiinduló, magas malignitású folyamat, a leggyakoribb felnőttkori nyirokszervi tumor. Mind a primér staging, mind a kezelés hatékonyságának lemérésére végzett FDG-PET/CT vizsgálat értékelése során a szubjektív megítélésen túl kvantitatív képi paraméterek is rendelkezésünkre állnak. Célunk a rutinszerűen alkalmazott terápia előtti FDG-PET/CT alapján elkülöníteni az agresszívabb, standard terápiára nem reagáló csoportot szemikvantitatív képi paraméterek segítségével.
Módszerek: A PET/CT-vizsgálatokat két klinikai központban végeztük 2014 és 2019 között, az egyik központban 41, a másikban 44 beteg vizsgálata történt meg. A képi biomarkerek közül a hagyományos SUV (Standardized Uptake Value) és térfogat alapú paramétereken túlmenően különböző texturalis paramétereket is meghatároztunk, melyek a radiofarmakon szöveti eloszlásának heterogenitását leíró paraméterek. A felvételek értékelése során a tumoros régiókat Interview Fusion program alkalmazásával ,,global treshold”(Mediso kft.) technikával, szemikvantitatív módon jelöltük ki. A követés során a 2 éves eseménymentes túlélést választottuk klinikailag releváns határértéknek. Az adatokat a továbbiakban Dedicaid AutoML Research csomaggal (Dedicaid GmbH, Bécs, Ausztria) automatizált gépi tanulásnak vetettük alá. Két éves eseménymentes túlélést előrejelző modellt hoztunk létre az egyik klinikai központ adatainak a felhasználásával. A másik klinikai központ adathalmazát az első központ adathalmaza alapján felépített prediktív modell kereszt-hitelesítésére használtuk. A szenzitivitást, a specificitást, a pozitív és negatív prediktív értékeket adtuk meg.
Eredmények: A standard kemo-immuno terápia végén 55 betegnél teljes metabolikus remisszió volt elérhető. Az utánkövetés során 14 beteg nem reagált a kezelésre, 14 beteg 12 hónapon belül relabált, 2 betegnél pedig 24 hónapon belül történt relapszus. Összesítve, a terápia befejeztével 30 betegnél volt még kimutatható, metabolikusan aktív tumorszövet, vagy 24 hónapon belüli relapszus. Az automatizált gépi tanulás alkalmazásával két éves eseménymentes túlélést előrejelző modellt hoztunk létre az első központ adatainak (n=41) a felhasználásával. Az elemzés alapján a legfontosabb képi paraméterek a 2 éves eseménymentes túlélés becsléséhez a következők bizonyultak: az egyes betegeknél kiválasztott tumoros lézió maximális átmérője=max diamater (mm), a TLG (Total Lesion Glycolisis), a MTV (Metabolikus Tumor Volumen (cm3), valamint két, a beadott radiofarmakon eloszlásának heterogenitását leíró texturális paraméter a Busyness és a Coarseness. Az első központból származó adatokra felépített prediktív modell segítségével a második központból származó betegeket 79%-os érzékenységgel, 83%-os specificitással, 69%-os pozitív, és 89%-os negatív prediktív értékkel lehetett besorolni a megfelelő csoportokba.
Összefoglalás: Eredményeink alapján – a szövettani és laboratóriumi vizsgálati adatok mellett – az FDG-PET/CT-vel nyert képi paraméterek alkalmasak lehetnek a standard kezelésre adott válasz, és akár a hosszabb távú prognózis becslésére.
2. A terápia előtti 18F-FDG PET/CT vizsgálat prognosztikai értéke perifériás T-sejtes lymphomás betegeknél
Czékus Tamás1, Besenyi Zsuzsanna1, Pávics László1, Német Rita1, Farkas István1, Sipka Gábor1, Mikó Zsófia1, Nagy Szanella1, Piukovics Klára2, Bakos Annamária1
1Szegedi Tudományegyetem Nukleáris Medicina Intézet
2Szegedi Tudományegyetem Belgyógyászati Klinika Hematológia munkacsoport
Bevezetés: Az érett postthymikus T- és NK-sejt eredetű perifériás T-sejtes lymphoma (PTCL) a malignus hematológiai betegségek heterogén, ritka csoportját képezi, az összes non-Hodgkin lymphoma kevesebb, mint 15%-t teszi ki. A 2016-os WHO klasszifikáció alapján az anaplasias nagysejtes, az angioimmunoblasztos és perifériás T-sejtes tovább nem osztályozható forma elsődlegesen nodalis kiindulású betegség, míg a nasalis típusú NK/T-sejtes, az intestinalis T-sejtes extranodalis eredetű. Az agresszív lymphomákban első vonalban alkalmazott hagyományos antraciklin tartalmú kombinált kemoterápiás kezelés hatékonysága T-sejtes entitásokban csekély, az 5 éves teljes túlélés alig éri el a 25%-ot. A lymphomákban alkalmazott nemzetközi prognosztikai index (IPI) T-sejt lymphomákra alakított változata (PIT score) alapján sem ítélhető meg pontosabban a kezelésre adott válasz és a betegség kimenetele. A nemzetközi T-sejt lymphoma projekt által használt pontrendszert (életkor, performance státusz, thrombocyta számot veszi alapul) kevés klinikai tanulmányban vizsgálták. A lymphomák stádium besorolásában a kezelés megkezdése előtt alkalmazott 18F-FDG PET/CT prognosztikus szerepe T-sejtes lymphomákban kevésbé elterjedt metódus, vizsgálatunk célja olyan metabolikus paraméterek meghatározása, mely eredményesen előrevetítheti a betegség várható kimenetelét.
Módszerek: A retrospektív vizsgálatunkba 18 beteget vontuk be (7 nő és 11 férfi, az átlagéletkor 61év, 36-81 év). Beválogatási kritériumok: szövettanilag igazolt PTCL betegség, a diagnózis felállítása óta eltelt legalább 12 hónap, valamint a szisztémás kemoterápia megkezdése előtt (baseline) 18F-FDG PET/CT vizsgálat készült. 18F-FDG PET/CT vizsgálat értékelése során kvantitatív módon meghatároztuk a teljes metabolikus tumor térfogatot (TMTV) és a teljes lézió glikolízist (TLG). A túlélési görbéket Kaplan-Meier módszerrel számoltuk, a csoportok közötti összehasonlítást pedig log-rank teszt segítségével határoztuk meg.
Eredmények: A medián követési idő 28 hónap volt. A kapott metabolikus paraméterek alapján két csoportot hoztunk létre. Az alacsony rizikójú betegek (12 fő) esetében a kapott TLG ≤ 898, MTVT≤315,7cm3 köztük az átlagos túlélés 29 hónap, a medián túlélés pedig 33 hónap. A másik csoportba kerültek a magas rizikójú betegek (6 fő), itt a TLG ≥3490,47, az MTVT≥498,34 cm3 az ő esetükben az átlagos túlélés 12 hónap, medián túlélés pedig 6 hónap. Az 1 éves túlélés (OS) az alacsony rizikójú betegek esetében 83,33%, a magas rizikójúak esetében pedig 33,33% lett. A két csoport között a túlélési valószínűségek szignifikánsan különböztek (TLG esetében p=0.029, a TMTV esetében pedig p=0.0272).
Következtetés: A perifériás T-sejt lymphomás betegek esetében a baseline 18F-FDG PET/CT vizsgálat alapján meghatározott TLG és TMTV független prediktív faktornak bizonyult, eredményesen azonosította a magas rizikójú betegeket. A non-Hodgkin lymphoma ezen ritka formájában a primer stádium meghatározás céljából végzett 18F-FDG PET/CT vizsgálat alkalmas módszer a magas rizikójú betegek kiemelésére, elősegítve ezzel a megfelelő terápia megválasztását.
3. Nem tapintható tüdőgócok minimál-invazív műtéti eltávolítása izotópos jelölés segítségével
Olajos Mirella1, Park Kyung-Jy1, Ghimessy Áron2,4, Csende Kristóf2,4, Andi Judit3,Téglás Melinda1, Agócs László2,4, Rényi-Vámos Ferenc2,4, Sinkovics István1
1Országos Onkológiai Intézet, Nukleáris Medicina osztály, Budapest
2Országos Onkológiai Intézet, Mellkasi Központ, Budapest
3Országos Onkológiai Intézet, Radiológiai Diagnosztikai osztály, Budapest
4Semmelweis Egyetem, Mellkassebészeti Klinika, Budapest
Bevezetés: Magyarországon a tüdőrák incidenciája és mortalitása a legmagasabb Európában. A rizikócsoportok szűrésének és a képalkotó vizsgálatok fejlődésének köszönhetően a mellkasi CT felvételeken ma már egyre kisebb (már néhány mm-es) tüdőgócok is felismerésre kerülnek. Az észlelt kicsiny gócok dignitása kérdéses, ezért ezeknek az elváltozásoknak a minimál-invazív (Video-Assisted Thoracic Surgery-VATS) eltávolítása diagnosztikus és terápiás szempontból is fontos. Mivel a sebész pár centiméteres metszésen keresztül operál, lényeges a tüdőgócok pontos lokalizációja különösen akkor, amikor a góc helyzete miatt a célterület áttapintása nem lehetséges. A góc preoperatív jelölésére több módszer áll rendelkezésre, ezek közük az egyik lehetőség a góc preoperatív CT- vezérelt radioizotópos jelölése.
Anyag és módszer: Az Országos Onkológiai Intézet Mellkasi Központjában 2017.01.01 és 2022.03.21 között 75 betegnél (33 férfi és 42 nő, átlagéletkor 63 év) történt nem tapintható tüdőgóc minimál-invazív eltávolítása izotópos jelölést követően. A tüdőgócok mérete 0,03 -2 cm közötti (átlag: 0,9 cm), a pleurától való távolságuk átlagosan 0,4 cm (0-2 cm) volt. CT vezérlés mellett 10-15 MBq aktivitású 99mTc jelzett human szérum albumint (Senti-Scint) adtunk be a góc mellé 0,2ml térfogatban. Az izotóp beadását követően a műtét elvégzésére 1-3 órán belül sor került. A sebész gamma szonda segítségével azonosította a megjelölt gócot, melyet lehetőség szerint ékrezekcióval távolított el. A műtét során a gamma szondával ellenőrizték az aktív góc eltávolításának sikerességét.
Eredmények: A góc megtalálása és teljes eltávolítása minden esetben sikeres volt. 49 esetben már ismert daganatos betegnél áttét, 18 betegnél primer tüdőtumor igazolódott. 8 betegnél a góc szövettani vizsgálata malignus folyamatot nem jelzett (gyulladás, hamartoma, tbc). Az izotóp beadása 43 betegnél teljesen szövődménymentes volt, 32 betegnél a jelentkező szövődmények (légmell, bevérzés, véres köpet vagy pleura leválás) ellátása a műtéti beavatkozás során nem okozott nehézséget. Azonnali beavatkozást igénylő súlyos szövődmény egy esetben sem alakult ki.
Következtetés: Eddigi tapasztalataink alapján a nem tapintható, CT vizsgálattal kimutatott tüdőgócok izotópos jelölése segítséget nyújt a gócok lokalizálásában és minimál-invazív technikával történő biztonságos eltávolításában. Lehetővé teszi a mélyebben elhelyezkedő gócok pontos jelölését és korrekt eltávolítását. A korábban alkalmazott drótos jelölés során a légzőmozgásoknak köszönhetően a drót gyakran elmozdult, ami a góc megtalálását és eltávolítását nehezítette, ami az izotópos jelölésnél elkerülhető. A módszer a korábban alkalmazott drótjelöléshez hasonlóan gyakran – beavatkozást sem igénylő – könnyen ellátható szövődménnyel járt.
4. Tüdőtumor molekuláris patológiai tulajdonságainak és FDG-felvételének összehasonlítása
Kiss Fanni Júlia1, Czibor Sándor1, Barra Magdolna1, Varga Zsolt1, Györke Tamás1
1Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék
BEVEZETÉS: A tüdőtumor a leggyakoribb malignus daganat világszerte, prognózisa és kezelése is jelentősen függ a szövettani és a molekuláris patológiai analízis eredményeitől. A mintavétel sokszor nehéz vagy sikertelen (pl. kiterjedt emphysaema miatt), ezekben az esetekben a képalkotó eljárások jelentős segítséget nyújthatnak a végső diagnózis megalkotásában. Kutatásunk során azt vizsgáltuk, hogy van-e összefüggés a daganat molekuláris patológiai tulajdonságai és FDG- felvétele között. Pozitív kapcsolat esetén sikertelen molekuláris patológiai analízis ellenére is hozzásegíthetnénk a betegeket a megfelelő diagnózishoz és az időben megkezdett, adekvát terápiához.
MÓDSZEREK: Munkánk során 73 ismert tüdőtumoros beteg (62 adenocarcinoma, 11 planocellularis carcinoma) intézetünkben készült primer staging FDG-PET/CT-felvételeit elemeztük. Összegyűjtöttük a molekuláris patológiai analízis eredményeit (53 K-Ras vad, 9 K-Ras mutáns, 23 PD-L1 negatív, 32 PD-L1 pozitív), ezt követően meghatároztuk a daganatokban mérhető maximális standardizált felvételi értéket (SUVmax), valamint a SUV csúcsértékét (SUVpeak). A kapott adatokat nem paraméteres statisztikai próba, Mann–Whitney-teszt segítségével hasonlítottuk össze. Az eredményeket medián ± interkvartilis terjedelem formában prezentáljuk.
EREDMÉNYEK: A K-Ras mutáns és a PD-L1 pozitív tumorok FDG-felvétele szignifikánsan magasabb volt, mint a vad és a negatív daganatoké (K-Ras esetén SUVmax: 21.4±9.7 vs. 13.6±6.3, SUVpeak: 18.4±7.8 vs. 10.6±5.5; PD-L1 esetén SUVmax: 15.4±6.9 vs. 11.3±8.4, SUVpeak: 12.8±5 vs. 8.7±6.5). Jelen kutatás során az adenocarcinomák és a planocellularis carcinomák FDG-felvétele szignifikánsan nem különbözött (SUVmax: 14.3±6.5 vs. 14.9±6.9; SUVpeak: 11.1±6.3 vs. 13.4±5.3).
KÖVETKEZTETÉS: A PET/CT-felvételek szemikvantitatív kiértékelése nemcsak a képalkotó diagnosztikában, hanem a molekuláris patológiai analízis során is támpontot nyújthat. Mind a SUVmax, mind a SUVpeak alkalmas paraméter lehet arra, hogy egyéb radiomikai és molekuláris biomarkerekkel karöltve elősegítse a pontosabb szövettani stratifikációt, hozzásegítve ezzel a betegeket a megfelelő diagnózishoz és az adekvát terápiához.
5. 99mTc-Mebrofenin SPECT/CT szerepe a máj funkcionális térfogatának preoperatív meghatározásában
Bakos Annamária1, Czékus Tamás1, Farkas István1, Géczi Tibor 2, Hőhn József2, Libor László2, Mikó Zsófia1, Nagy Szanella1, Német Rita1, Pávics László1, Sipka Gábor1, Urbán Szabolcs1, Besenyi Zsuzsanna1
1Szegedi Tudományegyetem Nukleáris Medicina Intézet
2Szegedi Tudományegyetem Általános Orvostudományi Kar Sebészeti Klinika
Bevezetés: A primer és metasztatikus májtumorok reszekálhatóságának feltétele, hogy a műtétet követően elegendő funkcionális májtömeg (future liver remnant – FLR) maradjon vissza, a májkeringés és epeelfolyás biztosított legyen. Elégtelen maradék májtérfogat esetén postoperatív májelégtelenség alakul ki, mely a beteg halálához vezethet. A 99mTc-mebrofenint -a bilirubinhoz hasonlóan- a működő hepatociták választják ki. Vizsgálatunk célja, a 99mTc-Mebrofenin SPECT/CT alkalmazásával kiterjedt, vagy akár többlépcsős májreszekciók esetén meghatározzuk a maradék májszövet funkcionális részesedését valamint CT-alapú volumetriát végezzünk.
Anyag és módszer: A Szegedi Sebészeti Klinikáról 13 esetet (7 férfi, 6 nő, átlagéletkor 54 év, 24-83 év) válogattunk be a következő kritériumok alapján: kiterjesztett májreszekció indikált, klinikailag igazolt kompenzált májműködés, a műtét aneszteziológiai szempontból nem kontraindikált. A már staging vizsgálaton átesett betegeknél a felhasi régióról natív, low dose CT felvételt követően 99mTc-mebrofenin intravénás beadása után 3,2 perces adatgyűjtéssel folyamatos SPECT leképezést végeztünk 60 percen át. A SPECT/CT felvételeken manuálisan kijelölt VOI-kon belül kvantitatívan meghatároztuk a máj parenchymás fázisában a teljes máj összbeütésszámát és térfogatát, majd a tervezett reszekció utáni FLR funkcionális és térfogat arányát a teljes májállományhoz képest (FLRV-F%, FLRV%). A vizsgálat napján ultrahangos shear wave elasztográfiás módszerrel megmértük a reszekálandó és maradék májrész rugalmasságát, mellyel a parenchyma fibrózisának mértéke határozható meg.
Eredmények: Egy beteg esetében (1/13) a preoperatívan meghatározott maradék májállomány nem bizonyult elégségesnek (FLRV: 35%, FLRV-F: 30%), így a beteg májparenchyma moduláción esett át. A beavatkozás után 7 héttel a maradék máj funkcionális részesedése megfelelő mértékben megnövekedett (FLRV: 55%, FLR-F:60%). Nyolc betegben (8/13) a számolt térfogati és funkcionális arány szignifikánsan eltért egymástól (átlag FLRV%=44,8% ±18,6; átlag FLRV-F=61% ±11,9, p=0,029). Ezen esetekben a reszekálandó máj lényegesen alacsonyabb funkcionális részesedésének hátterében a vizsgálatot megelőző véna portae okklúziót vagy a tumor centralis lokalizációját találtuk. A reszekálandó májban elasztográfiával mérsékelt vagy kifejezett fibrózist detektáltunk, melyet a posztoperatív szövettani vizsgálat is igazolt. További 5 betegben (5/13) a maradék máj térfogati és funkcionális részesedése jelentősen nem különbözött (átlag FLRV%: 46,6% ±20,9; átlag FLRV-F: 46,4% ±23,2, p=0,49). Négy betegben (4/5) érdemi májparenchyma eltérés sem elasztográfiával sem szövettanilag nem igazolódott, egy betegben (1/5) pedig mindkét lebenyt érintő cirrhosisnak megfelelő fibrózist mutattunk ki elasztográfiával. A vizsgálatunkba bevont 13 beteg esetében posztoperatív májelégtelenség egyetlen esetben sem volt.
Következtetés: A kiterjesztett májreszekciók esetében a CT volumetria önmagában nem ad megfelelő képet a maradék máj funkcionális kapacitásáról. A 99m Tc-mebrofenin SPECT/CT alkalmazásának szerepe jelentős a kiterjesztett májreszekciók preoperatív tervezésében, elősegítve a műtét biztonságos elvégzését.
6. Lymphoszcintigráfia segítségével végzett sentinel node biopszia szerepe hímvessző carcinómában
Szili János1, Radácsi Andrea1, Berta Tibor2, Beöthe Tamás2, Sülecz István2, Buzogány István2
1Affidea Magyarország Kft. – Péterfy Kórház, Izotópdiagnosztika Részleg, Budapest
2Péterfy Kórház-Rendelőintézet Országos Traumatológiai Intézet, Urológia Osztály, Budapest
Bevezetés: Hímvessző carcinómás betegekben a nyirokcsomó státusz nagyon fontos prognosztikai faktor. Az inguinalis nyirokcsomók kiterjedt dissectioja gyakran jár szövődménnyel, lymphoedemával. Klinikailag negatív nyirokcsomó státuszú hímvessző carcinómás betegekben őrszem nyirokcsomó biopszia javasolt, melynek lehetséges módja lymphoszcintigráfia segítségével végzett biopszia.
Anyagok és módszer: Retrospektív vizsgálattal, 2008 és 2021 között, 15/35 esetben történt lymphoszcintigráfia segítségével végzett sentinel node biopszia a kórházunkban kezelt hímvessző carcinómás betegekben. A radiofarmakont – Tc-99m Sentiscint, a műtét előtti napon adtuk be, peritumoralisan, intracutan, két depot-ban. 4h múlva statikus és SPECT/CT felvételeket készítettünk az őrszem nyirokcsomó detektálására. A műtét alatt gamma szondával történt az őrszem nyirokcsomó azonosítása. Pozitív szövettani eredmény után kiterjesztett inguinalis nyirokcsomó dissectio történt.
Eredmények: Negatív sentinel nyirokcsomó biopsziás eredménnyel rendelkező betegek hosszabb távon is negatívnak bizonyultak. Egy esetben fordult elő, hogy negatív lelet ellenére szisztémássá vált a betegség.
Megbeszélés: Az Európai Urológus Társaság Irányelvével összhangban hazánkban kórházunkon kívül egyedül a pécsi Egyetemen alkalmaznak rutinszerűen lymphoszcintigráfia segítségével végzett őrszem nyirokcsomó biopsziát hímvesszőrák esetén. A módszer megfelelő lehet a klinikailag nyirokcsomó negatív hímvessző rákos betegekben a kiterjesztett ingunalis nyirokcsomó dissectio elkerülésére, illetve a metasztatikus érintettség kimutatására, kellő tapasztalatú centrumokban.
7. Pajzsmirigyben kialakuló forró göbök diagnosztikája, követése és terápiája
Szkibák Noémi1, Barna Sándor2, Garai Ildikó2, Andrási Mónika3, Győry Ferenc3, Nagy V. Endre4, Erdei Annamária4
1Debreceni Egyetem Általános Orvosi kar, Debrecen
2Scanomed Kft, Debrecen
3Debreceni Egyetem Klinikai Központ, Sebészeti Intézet, Debrecen
4Debreceni Egyetem Klinikai Központ, Belgyógyászati Intézet, Endokrinológiai Tanszék, Debrecen
Bevezetés: A pajzsmirigygöbök incidenciája fokozatosan növekszik. A göbök egy része forró göb, mely diagnózis az ultrahang mellett a pajzsmirigy szcintigráfián alapul. Tankönyvi adatok alapján a forró göbökben a malignitás rizikójával a napi rutin betegellátásban nem kell számolni, viszont pajzsmirigy túlműködés kialakulhat. Hyperfunkció esetén a terápia 3 cm-es göbméret alatt általában radiojód kezelés, 3 cm felett pedig műtét. A göbök diagnosztikájára vonatkozó protokollok 1 cm-es göbméret felett a vékonytű aspirációs cytológiát helyezik előtérbe és a szcintigráfia szerepe háttérbe szorul, csak szupprimált TSH vagy multinodularis struma esetén javasolják használatát. Ebből következik, hogy a normál TSH mellett jelen lévő solitaer, 1 cm-nél nagyobb forró göbökből a protokoll szerint mintavétel történik és – az ilyen esetben gyakori C3/B3 cytológiai lelet alapján – műtétre kerülhet sor.
A pajzsmirigyben lévő forró göbök természetes lefolyásának vizsgálata, illetve a fenti ellentmondásokra válaszokat keresni.
Anyag és Módszer: Retrospektív vizsgálatunk során a DE KK endokrinológiai szakrendelésein 2010 és 2021 között forró göbbel követett betegek adatait dolgoztuk fel a kórházi infomációs rendszerből nyert adatok alapján.
Eredmények: 306 beteg (260 nő, 46 férfi, átlagéletkor 57.3 ± 13.4 év) adatait elemeztük. A vizsgált pajzsmirigyek közül 77 solitaer forró göböt tartalmazott és 228 esetben multinodularis strumája volt a betegeknek. A pajzsmirigy szcintigráfia időpontjában az átlagos TSH érték 0.79 [iqr: 0.16, 1.52] volt. Hyperfunkció 20 [iqr: 15, 28] mm átlagos göbméretnél jelent meg. A követési időszak alatt 59 betegnél történt műtét, a leggyakoribb műtéti indikáció a göbméret volt (28 eset). Az operált betegek közül 9-nél igazolódott rosszindulatú daganat a forró göbben. Hyperfunkció és göbméret csökkentés céljából 42 esetben történt radiojód kezelés.
Következtetések: A pajzsmirigy göbök diagnosztikájában az izotóp vizsgálat elvégzése válogatott esetekben „a protokollokon túl” is hasznos lehet. Forró göbökben a malignitás előfordulásának gyakorisága a korábban gondoltnál magasabb lehet, emiatt nagyobb esetszámú, multicentrikus vizsgálatok elvégzése lenne szükséges.
8. A könnyszcintigráfiás módszer új szemészeti alkalmazása
Bencze Viktória1, Kiss Anett1, Garai Ildikó1, Barna Sándor1
1Scanomed Kft, Debceren
A precornealis könnyfilm egészséges egyénekben egyenletesen eloszló védőréteget képez a szem elülső felszínén. A szárazszem-betegség vezető oka a Meibom-mirigy diszfunkció, mely során a mirigyet érintő krónikus, diffúz elváltozás következtében felbomlik a könnyfilm egyensúlya a lipid réteg szintetizálásának és kiválasztásának elégtelensége miatt.
Vizsgálatunkban elemeztük a könnyszcintigráfia diagnosztikai értékét olajos, lubrikáló szemcseppel kezelt betegek körében.
A vizsgálatban 29 beteg vett részt, 21 nő és 8 férfi. Átlagéletkoruk 63 év volt. A betegek és a gamma kamera megfelelő pozícionálása után mindkét szembe 1-1 csepp 100MBq/ml töménységű 99mTc-pertechnetátot cseppentettük, majd dinamikus képsorozatot gyűjtöttünk a szemek megfelelő régióiról, kézzel korrigálva az esetleges véletlen elmozdulásokat. Ezután 1-1 csepp Systane Balance szemcseppet alkalmaztunk a betegek mindkét szemén, majd 1, illetve 3 óra elteltével megismételtük a könnyszcintigráfiát.
InterView XP szoftver segítségével külön-külön feldolgoztuk a vizsgálatok során kapott dinamikus képsorozatokat. Összegképeket készítve időaktivitás görbét hoztunk létre, melyre exponenciális függvényt illesztve vizsgáltuk annak felezési idejét.
Az alapvizsgálat során elhúzódó könnyclearence értékeket kaptunk. A vizsgált szemek esetén a kiinduló T1/2 érték szignifikánsan csökkent a korral (p=0.017). Mind az 1 órás, mind a 3 órás felezési idő szignifikánsan rövidebb az alapvizsgálaténál (p<0.0001). Az 1 és 3 órás érték (a többszörös összehasonlításra történt Bonferroni-korrekció után) nem különbözik szignifikánsan (p>0.1).
A könnyszcintigráfia kiváló kiegészítő vizsgálati módszer lehet a szárazszem-betegség diagnosztikájában és a terápia hatásosságának nyomon követésében.
9. Az életkor, a BMI és a diabetes, mint agyi perfúziót befolyásoló független tényezők
Képes Zita1, Nagy Ferenc2, Budai Ádám2, Barna Sándor2, Esze Regina3, Somodi Sándor3, Káplár Miklós3, Garai Ildikó1,2, Varga József 1
1:Debreceni Egyetem, Általános Orvostudományi Kar, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Debrecen, Magyarország
2:Scanomed Kft., Nukleáris Medicina Központok, Debrecen, Magyarország
3:Debreceni Egyetem, Általános Orvostudományi Kar, Belgyógyászati Intézet, Belgyógyászati Klinika A épület, Debrecen, Magyarország
Bevezetés: A cerebrális véráramlást érintő abnormalitások a kognitív diszfunkció kialakulásának potenciális rizikótényezői. Az öregedés, az elhízás és a II-es típusú diabetes mellitus (T2DM) összefüggésbe hozható kognitív zavarok, neurodegeneráció és demencia kialakulásához vezető agyi perfúziós eltérésekkel. Tanulmányunkban, általános lineáris modell alkalmazásával (az occipitális lebenyre normalizált) agyi perfúziót befolyásoló független tényezőket kerestünk a betegség (T2DM, obezitás) és a nem, mint faktorok, valamint az életkor, a vércukorszint és a testtömegindex (body mass index/BMI), mint kovariánsok között.
Betegek és módszerek: Negyvenhárom T2DM-ben (életkor: 50.00±8.59 év; BMI: 32.41±5. 28 kg/m2) és 26 elhízásban (életkor: 53.50±9.89 év; BMI: 35.68±5.58 kg/m2) szenvedő beteg adatait dolgoztuk fel. A szérumglükózszinteket spektrofotometriás módszerrel szérummintából határoztuk meg (Roche Diagnostics). 709±42 MBq 99mTc-hexametil-propilén-amin-oxim ([99mTc]HMPAO, Mediradiopharma, Hungary) intravénás injektálását követően AnyScan S Flex kétfejes gamma kamera segítségével (Mediso, Hungary) agyi perfúziós SPECT vizsgálatot végeztünk. Az agyatlaszt technika alkalmazásához kiegészítő T1-súlyozott MR felvételek készültek (Achieva 3.0T (TX)-DS, Philips). A koregisztrált SPECT és MR felvételeket az MNI152 atlasztérbe transzferáltuk, melyet követően a következő standard VOI-kat (volume of interest) helyeztük fel: frontális lebeny, parietális lebeny, temporális lebeny, occipitális lebeny, limbikus régió, cingula régió, inzula, bazális ganglionok, nagyagy, limbikus rendszer és agytörzs. Az SPSS25 programcsomagot használva, általános lineáris regressziót, Student-féle t tesztet és Mann-Whitney U tesztet alkalmaztunk a statisztikai analízishez.
Eredmények: A BMI és a kor mutatott szignifikáns (p<0.0001) összefüggést az agyi perfúzióval, míg a betegség jelenlétével való összefüggés jelzetten haladta meg a statisztikai küszöböt (p=0.0524). A többszöri összehasonlításra végzett Hochberg-féle korrekciót követően megfigyeltük, hogy a DM jelenléte független, és szignifikáns (normalizált) perfúziót befolyásoló tényező az inzula régiójában (p<0.001). Egyéb, (normalizált) perfúziót befolyásoló független faktorok: az életkor az inzulában (p<0.001) és a limbikus régióban (p<0.01), illetve a BMI az agytörzsben (p<0.01).
Konklúzió: Az életkor és a BMI általános, a diabetes regionális agyi hypoperfúziót előidéző tényezőnek bizonyult. Kimutattuk, hogy a BMI új, agyi keringést befolyásoló faktor. Specifikusan az inzula régiójában különbséget találtunk az obez és a diabeteses betegcsoport között. Ezek az eredmények jelentősek lehetnek a metabolikus betegségekben esetlegesen kialakuló kognitív diszfunkció megértése szempontjából.
10. Histero-szalphingo szcintigráfia jelentősége a SPECT/CT korában
Barna Sándor1, Lőrincz Judit2 Dinkó Fanni3, Hermann Tünde2, Török Péter2, Garai Ildikó1
1Scanomed Kft, Debrecen
2Debreceni Egyetem KK, Nőgyógyászati Klinika, Debrecen
3SzSZBMK Jósa András Oktatókórház Radiológia osztály
A meddőség előfordulása a WHO által közzétett adatok szerint folyamatosan növekszik. A családalapítási szándékkal rendelkező párok 8-12%-a meddő. A meddőség hátterében anatómiai, genetikai, immunológiai, hormonális vagy pszichés rendellenesség vagy elváltozás állhat. A női meddőség 40%-a petefészekproblémákra, 30%-a a méhszájra vezethető vissza, és csak 5-10%-nak genetikai rendellenesség az oka.
A petevezeték átjárhatósága több módszerrel is vizsgálható, ezek közül rutinszerűen alkalmazzák a hisztero-kontraszt-szonográfiát (HyCoSy), a hiszteroszalpingográfiát (HSG) és a hiszteroszalpingoszcintigráfiát (HSSG). Mindazonáltal az invazív laporoszkópos kromopertubáció a petevezető állapotának értékelésében az goldstandard.
Vizsgálatunk célja az volt, hogy megvizsgáljuk a HSSG hatékonyságát SPECT/CT-vel a petevezetékek áteresztőképességének megítélésében.
Betegek és módszerek: Intézményünkben 2017.03.01. és 2019.12.01. között 70 meddő női beteget (átlagéletkor: 31 év) vizsgáltunk. A vizsgálatokat a menstruációs ciklusuk 7-14. napján végeztük. A betegek fekvő helyzetben feküdtek a gamma-kamera alatt. Egy nőgyógyász asszisztenciájával 37 MBq 99mTc nanoalbumont juttattak be a méhüregbe helyezett katéteren keresztül. Először 40×30 másodperces dinamikus felvételeket készítettünk (egyszerű dinamikus). Ezután 5 ml fiziológiás sóoldatos folyadék közvetlen beadásával kikényszerítettük a bejuttatott radiofarmakon áramlását, és újabb dinamikus felvételeket készítettünk 10×30 másodperces felvételekkel (forszírozott dinamikus). Végül további SPECT/CT (128×128 mátrixméret, 10 mp/képkocka, 120 kV és 10 mAs) készült a kismedencei terület aktivitásának lokalizálására (forszírozott SPECT).
Eredmények: A különböző akvizíciós módszereket diagnosztikai teljesítményük szerint értékeltük. Azt találtuk, hogy a forszírozott SPECT mutatta a legjobb diagnosztikus teljesítményt az egyszerű és a forszírozott dinamikus vizsgálattal szemben (szenzitivitás 100%, 87%, 87%, specificitás 89%, 72% és 89%). Mindegyik módszer kiváló negatív prediktív értékkel rendelkezik (100% az erőltetett SPECT és 97% a dinamikus módszerek esetében). A CT nem szolgáltatott jelentős többletinformációt.
Megbeszélés: A HSSG jó negatív prediktív értékkel bíró kiváló, egyszerű diagnosztikai módszer a petevezetékek áteresztőképességének értékelésére. Kizárólag forszírozott SPECT alkalmazásával dinamikus felvétel nélkül is javíthatjuk a diagnosztikai pontosságot. Ez időigényes és kényelmesebb a beteg számára. Nincs szükség további kiegészítő CT-re, mellyel a módszer sugárterhelése tovább csökkenthető.
11. Retrobulbáris 99mTc-DTPA SPECT/CT kvantitatív értékelése és összevetése a korábbi SPECT eredményekkel.
Mihovk Iván 1, Galuska László 1, Varga József 1, Nagy V. Endre 2, Nagy Edit 3, Barna Sándor4
1Debreceni Egyetem, Általános Orvosi Kar, Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék, Debrecen
2Debreceni Egyetem, Klinikai Központ, Belgyógyászati Intézet, Endokrinológia, Debrecen
3Debreceni Egyetem, Általános Orvosi Kar, Orvosi Képalkotó Intézet, Radiológiai Tanszék, Debrecen
4Scanomed Kft., Debrecen
Bevezetés: Az endocrin ophtalmopathia, a Graves-Basedow kórt gyakran kísérő, a retrobulbaris szövetek gyulladásával járó autoimmun folyamat, amely az érintett betegek életminőségét ronthatja, valamint egyes esetekben látásvesztéssel is járhat. A folyamat biológiai aktivitásának megítélése központi szerepet játszik a megfelelő terápiás eljárás kiválasztásában, mivel az immunszupresszív kezelés, valamint az esetleges szemüregi irradiáció csak a gyulladás aktív fázisában járhat sikerrel. A 99mTc-DTPA-t alkalmazó retrobulbaris SPECT vizsgálat költséghatékony, egyszerűen kivitelezhető és hatékony módszernek tekinthető a fenti kérdés megválaszolásában. A low-dose CT, a kvantitatív rekonstrukció, és a felvételek feldolgozásának új módszerei a vizsgálat egyszerűsített kivitelezésének és kiértékelésének céljából kerültek bevezetésre.
Anyag és módszer: A vizsgálatba 13 beteg került bevonásra, a Scanomed debreceni központjában 2019.03.01. és 2019.04.30. között. A betegek kb. 400MBq 99m-DTPA-t (MediRadioPharma Kft., Érd) kaptak intravénásan, majd pontosan 20 perc akkumulációs idő után a koponya régiójáról SPECT/CT felvétel készült. A low-dose CT felvételeket gyengítéskorrekció és a pontos kiértékelés céljából vettük fel.
Az összes beteget az AnyScan SPECT/CT FLEX (MEDISO Kft., Budapest) berendezésen vizsgáltuk meg, a következők paraméterekkel: 128 nézet, 30 másodperc nézetenként, 128×128 mátrix méret, 2,36 pixelméret. CT paraméterek: 120kV, 40mAs, 1,5 pitch, 90/min rotációs sebesség, abdomen filter, 1,25mm szeletvastagság.
A vizsgálatot követően a felvételek rekonstrukcióját az Interview XP 3 (Mediso Kft., Budapest) verziójú szoftverével végeztük a következő paraméterekkel: Brain perfusion profil: 128×128-as felbontás, 48 iteráció, 4 subset. A rekonstrukciós panelen a gyengítés korrekciót és a „Use Quantitation” paramétert bekapcsoltuk. A rekonstrukció indítása előtt ellenőriztük, hogy a SPECT és a CT össze van-e regisztrálva, mivel a beteg elmozdulhatott a két vizsgálatrész közt.
Három feldolgozási módszer került kipróbálásra, és lett összevetve a rutinban jelenleg alkalmazott eljárással. Az A megnevezésű módszernél, három (transaxialis, sagittalis, coronalis) nézetben kerestük meg a retrobulbáris tér centrumát, majd ebbe egy 2 cm átmérőjű gömbVOI-t helyeztünk, ennek értékeit kiírtuk. A B módszernél, az axiális metszeti képeken az adott retrobulbáris teret szabadkezi VOI rajzolási technikával körberajzoltuk, így egy kúpszerű VOI-t kaptunk. A C módszerben a három fent jelzett síkban megkerestük a retrobulbáris térben a legaktívabb régiót, majd annak a centrumára egy 1,2 cm átmérőjű gömbVOI-t helyeztünk.
Eredmények: Az „A” módszer esetében a ppm/ml, az összaktivitás, az eredeti SUVmean és a SUVmax értékek korreláltak legjobban a referencia módszerrel.
Következtetés: Az alkalmazott SPECT/CT módszerek közül az „A” módszernél ismertetett VOI felrajzolásával kapott értékek korreláltak leginkább a referencia módszerrel. A jobb reprodukálhatóság miatt ezzel a módszerrel mért ppm/ml érték javasolt a referencia módszer értékeinek helyettesítésére.
2022. május 20. péntek, 10:00 – 12:00, Nukleáris medicina technika
1. Automatikus tüdőszegmentáló program hatékonyságának vizsgálata tüdőnodulus miatt vizsgált betegekben: kezdeti eredményeink
Mikó Zsófia1, Szabó Eszter2, Urbán Szabolcs1, Csirik János2, Besenyi Zsuzsanna1, Pávics László1
1SZTE Szent-Györgyi Albert Klinikai Központ, Nukleáris Medicina Intézet, Szeged
2SZTE Természettudományi és Informatikai Kar, Szeged
Bevezetés: A primer vagy áttéti malignus tüdőléziók pontos lokalizálása a terápia tervezés és a betegkövetés szempontjából egyaránt fontos. Ez teremtette meg az igényt egy automatikus tüdőszegmentáló program kifejlesztésére, amely a képi adatok elemzésével segítséget nyújthat a tüdőnodulusok lokalizálásában. Kutatásunk célja egy újonnan kifejlesztett automatikus tüdőszegmentáló program hatékonyságának vizsgálata volt.
Eszközök és módszerek: A kutatásba választott 28 beteg tüdejében összesen 48 léziót detektáltunk. A fenti páciensek mindegyike 18-FDG PET/CT egésztest vizsgálatra érkezett intézetünkbe, melyet nyugodt légzés mellett végeztünk (A csoport). Ezt követően minden esetben sor került egy légzésvisszatartás mellett készült mellkas CT vizsgálatra is (B csoport). A tüdőgócok lokalizációját egymástól függetlenül két nukleáris medicina szakirányú orvos adta meg a Boyden-féle nevezéktan alapján. A kérdéses esetekben az diagnoszták közösen formáltak véleményt. Az automatikus és a vizuális értékelés során kapott eredményeket lebeny és szegmentum szinten is elemeztük a PET/CT és a mélybelégzés mellett készült mellkas CT vizsgálat esetében is.
A csoportokon belül további három kategóriát alkottunk:
1: teljes egyezés (a vizuális értékelés alapján a góc helyéül megadott szegmentum egyezett az automatikus értékelés során megadott szegmentummal)
2: részleges egyezés (a program a megfelelő régióban határozta meg az adott lézió helyét, de nem tudott egy konkrét szegmentumot megjelölni)
3: nincs egyezés (a vizuális és az automatikus értékelés során megadott lokalizációk nem egyeznek)
Eredmények: A tüdőlebenyek tekintetében az A és a B csoport képeinek elemzése során minden esetben teljes egyezést tapasztaltunk. Az A csoportban a tüdőszegmentumok szintjén az esetek többségében (38/48) jó egyezést tapasztaltunk a vizuális és az automatikus értékelés eredményei között (13 esetben teljes, 25 esetben részleges egyezést láttunk, 10 esetben nem volt egyezés). A B csoportban ez az arány 36/48 volt (24 esetben láttunk teljes, 12 esetben részleges egyezést, 12 esetben nem volt egyezés).
Következtetés: Az automatikus és a vizuális értékelés az esetek többségében jó egyezést mutatott nemcsak a lebenyek, de a tüdőszegmentumok szintjén is. Az új fejlesztésű tüdőszegmentáló program validálása során kapott ígéretes eredmények tükrében azt a mindennapi gyakorlatban a leletírás során jól használható, a munkafolyamatot gyorsító eszköznek tartjuk.
2. Agyi vérátfolyás SPECT vizsgálatok automatikus kvantitatív elemzése: előzetes eredmények
Urbán Szabolcs1, Sipka Gábor1, Balogh András2, Besenyi Zsuzsanna1,, Csirik János2, Pávics László1
1Szegedi Tudományegyetem, Nukleáris Medicina Intézet, Szeged
2Szegedi Tudományegyetem, Informatikai Intézet, Szeged
Bevezetés: Az agyi vérátfolyás SPECT vizsgálat acetazolamid teszttel kiegészítve jelenleg is rutinszerűen alkalmazott, megbízható módszer a cerebrovascularis rezerv kapacitás csökkenésének meghatározására. A napi rutin során a leletezés általában vizuálisan történik, azonban a kvantitatív kiértékelés során olyan többlet információkhoz juthatunk, mely jelentős mértékben javíthatja a személyre szabott terápiát. Vizsgálatunk célja egy új, automatikus kvantitatív kiértékelő módszer kifejlesztése, mely a nyugalmi és acetazolamid terheléses agyi vérátfolyás SPECT-ek közötti különbségeket képes megbízhatóan, jó hatásfokkal detektálni. Anyag és módszer: Az automatikus módszer öt fő lépésből áll: 1) SPECT képek transzformálása az MNI térbe merev-test és affin transzformációkkal; 2) a képek normalizálása a kisagy átlag intenzitásának felhasználásával; 3) különbség-kép létrehozása a két SPECT felvételből; 4) kóros régiók detektálása egy automatikus, IQR (Inter Quartile Range) alapú módszer segítségével; 5) a detektált régiók méretének, anatómiai helyének és a különbség mértékének meghatározása. Az eredménye validálása két lépésben történt, 15 beteg SPECT felvételeinek felhasználásával (7 férfi, 8 nő, átlag életkor: 66 év). Először a talált kóros régiók vizuális elemzése és cimkézése (igazolt, nem igazolt, valószínűsíthető) történt meg. Ezt követően történt meg az automatikusan talált régiók összehasonlítása a vizuális értékelés eredményeivel. Eredmények: Az automatikus módszer az összes kóros régiót felismerte. Összesen 129 csökkent vascularis rezervkapacitású régió került azonosításra. Ezek közül 42 (32.56%) régió vizuális értékeléssel is igazolt vagy valószínűsíthető volt. A módszer által detektált igazolt vagy valószínűsíthető régiók térfogata szignifikánsan különbözött a nem igazolt régiók térfogatánál (Kruskal-Wallis, P<0,0001). Az igazolt régiók nem különböztek szignifikánsan a nem igazolt régióktól (Kruskal-Wallis, P>0.05). Következtetés: Egy új, automatikus módszer került bemutatásra, amely az agyi perfúziós vizsgálatok kvantitatív elemzését teszi lehetővé. A kiértékelések alapján a módszer az összes korábban kórósnak ítélt régiót detektálta. További fejlesztések szükségesek a detektált régiók nagy számának csökkentése érdekében, hogy a módszer csak a klinikailag releváns régiókat detektálja.
3. Metabolicus heterogenitás lymphomákban, 18FDG-PET/CT vizsgálattal
Fábián Krisztián1, 3, 4, Czibor Sándor1, Csatlós Zselyke2, Kári Béla1, 4, Györke Tamás1
1Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
2Semmelweis Egyetem, Általános Orvosi Kar, Budapest
3Budapesti Műszaki és Gazdaságtudományi Egyetem, Villamosmérnöki és Informatikai Kar, Budapest
4Mediso Kft., Budapest
Bevezetés: A 18F-FDG PET/CT képalkotó vizsgálatok által szolgáltatott információkat napjainkban lymphomák esetében széles körben alkalmazza a klinikum stádiummeghatározás, terápiás válasz- és prognózispredikció céljából. A konvencionális PET paraméterek jelenleg is részét képezik a képalapú biológiai tumorkategorizálás eszköztárának, azonban az elmúlt évek kutatási eredményei alapján a PET felvételekből nyert radiomikai jellemzők által biztosított tumorkategorizálási lehetőségek is ígéretesnek bizonyulnak.
Célkitűzés: Vizsgálataink elsősorban egy olyan metodika megalkotására irányultak, amely mentén, standard 18F-FDG PET/CT felvételekből könnyűszerrel, testreszabottan kinyerhetők a radiomikai jellemzők. Ezen felül vizsgálni kívántuk a megalkotott módszertan által biztosított képi jellemzők diffúz nagy B-sejtes lymphomára (DLBCL) vonatkozó differenciálási képességeit.
Módszer: Összesen 35, DLBCL kórképben szenvedő páciens baseline 18F-FDG PET/CT felvétele került feldolgozásra a tanulmány keretein belül. A PET/CT felvételeken szegmentálásra kerültek a DLBCL szempontjából releváns, fokozott halmozást mutató PET-térfogatok, amelyeket egyenként átadtunk egy radiomikai elemzőszoftvernek. A szoftver kimeneti adathalmazához hozzárendeltük a páciens betegségére vonatkozó változókat (LDH szint, GC/nonGC státusz), majd a statisztikai vizsgálatok keretein belül ROC (Reciever Operating Characteristic) analíziseket végeztünk 60 radiomikai jellemző LDH szintre és nGC/GC státuszra vonatkozó differenciálási képességének megállapítása céljából.
Eredmények: A ROC-elemzés kimenete alapján csekély számú jellemző mutatott mérsékelt pontosságot a differenciálás szempontjából. LDH szintre vonatkozó differenciálási képességet a Contrast (AUC=0,78), a Coarseness (AUC=0,77) és a Short Run Emphasys (AUC=0,75) jellemzők mutattak. GC/nonGC klasszifikációt csak a 90Percentile (AUC=0,608) formai jellemző tudta differenciálni, azonban alacsony pontossággal.
Következtetések: A munkánk során kidolgozott metodika eredményesnek bizonyult, használata integrálható további vizsgálatokba, akár egyéb malignus kórképek PET-vizsgálatainak elemzésére is. Az ily módon szerzett radiomikai jellemzők differenciálási és prediktív képességeinek megállapítására szolgáló statisztikai vizsgálatok nagyobb esetszám és több, betegségre vonatkozó változó mellett további lehetőségeket rejtenek.
4. CT dózis optimalizálás nukleáris medicina munkahelyek hibrid képalkotó vizsgálatainál
Kolozsi Zoltán1, Szugyiczki Viktória1, Bakos Magdolna1
1Békés Megyei Központi Kórház Nukleáris Medicina Osztály, Gyula
Bevezetés (Background): A sugárterheléssel járó vizsgálatoknál az egyik alapelv, hogy a páciensek sugárvédelmét optimálni kell. A személyi dózis az elérhető legalacsonyabb szinten kell tartani, és a kívánt diagnosztikai eredményt az elérhető legalacsonyabb sugárterheléssel kell megszerezni. A nukleáris medicina munkahelyek hibrid képalkotó eljárásainál a páciens sugárterhelésének jelentős része a CT (Computed Tomography) vizsgálatból származik, így optimalizálásuk és a diagnosztikai irányadó szintek (DRL – Diagnostic Reference Level) rendszeres felülvizsgálata különösen indokolt.
Anyag és módszer (Methods): A felmérések a Békés Megyei Központi Kórház Nukleáris Medicina Osztályán lévő Mediso gyártmányú Anyscan SPECT/CT/PET típusú hibrid képalkotó berendezésén lettek végezve. Több CT technikai paraméter (röntgen csőfeszültség, áramerősség, pitch, forgási idő, automata dóziscsökkentés) hatását vizsgáltuk a képminőségre vonatkozóan. A felvételeket egy Alderson RANDO humán fantomról készítettük, melyeknél megvizsgáltuk az előbbiekben felsorolt paraméterek hatását a dózisra (CTDI – Computed Tomography Dose Index és DLP – Dose Length Product), a képzajra és egy orvos által készített szubjektív vizuális pontozásra. A fentiek tükrében optimalizáltuk a CT paramétereket, majd összehasonlítottuk a különböző beállítások mellett végzett csontszcintigráfiai vizsgálatok során készült SPECT/CT felvételek CT dózisokat. Az utóbbiakat összevetettük nemzetközi diagnosztikai irányadó szintekkel.
Eredmények (Results): Várakozásoknak megfelelően a vizsgálatok kimutatták, hogy a CT csőfeszültség vagy az áramerősség csökkentésével jelentősen csökkenthető a pácienst terhelő sugárdózis, viszont fokozódik a kép zaja, így az orvosok számára kevésbé értékelhető felvétel nyerhető. A pitch érték növelésével is csökkennek a CTDIvol értékek, viszont ebben az esetben már nem tapasztaltunk jelentős kép zaj növekedést. A CT körbefordulási idejének növelése (a csőáram-idő szorzat mAs és egyéb beállítás változatlansága mellett) csak akkor eredményez páciens sugárterhelés növekedést, ha az automata dóziscsökkentő opciót használva tesszük ezt. Az említett automata dózismoduláció képes csökkenteni a dózist, azonban használatuknál figyelni kell az egyéb paraméterek beállításaira. Az előbbiekben felsorolt beállítások megfelelő megválasztásával a csontszcintigráfiai vizsgálatok kiegészítő SPECT/CT felvétel készítése esetén a CT-ből eredő sugárterhelése akár felére is csökkenthető.
Következtetés (Conclusion): A nukleáris medicina vizsgálatok jelentős részénél ahhoz, hogy morfológiai információt nyerjünk CT-vel kombinálják a SPECT vagy PET leképezéseket. A CT beállítások megismerésével, az egyes paramétereket hatásainak megértésével és megválasztásával a pácienseket érő sugárdózis jelentősen csökkenthető. A sugárterhelések optimálásának érdekében érdemes a vizsgált paramétereket rendszeresen felülvizsgálni a diagnosztikai irányadó szintek alkalmazásával együtt.
5.Újonnan üzembe helyezett PET/CT berendezés gyűjtési protokoll optimalizációja
Kulcsár Tamás1, Oszlánszki Attila2, Bátyi Ferenc2, Farkas Bence2, Garai Ildikó2, Hascsi Zsolt2
1Debreceni Egyetem Általános Orvosi kar, Debrecen
2Scanomed Kft, Debrecen
BEVEZETÉS: A képalkotó kamerák üzembe helyezése mérnöki feladat, ugyanakkor a gyári beállítások finomítása és a helyi protokoll beteglogisztikának megfelelő optimalizálása az applikációs csapat feladata.
CÉL: Célunk az újonnan telepített, digitális detektorral rendelkező PHILIPS Vereos PET/CT készülék PET képi rekonstrukciójának optimalizációja, és a gyűjtési idő beállítása volt.
MÓDSZEREK: Betegvizsgálatokat végeztünk a rekonstrukciós paraméterek optimalizációjára és a gyűjtési idő csökkentésére vonatkozóan. A betegek szokványos előkészítését követően 3,5 MBq/ttkg FDG-t kaptak intravénásan, majd 60 perc múlva PET/CT leképezés történt.
(PET gyűjtés: 60-120 min/frame BMI csoporttól függően, LDCT: 50-100 mAs, 120 kV)
- Rekonstrukciós paraméterek kiválasztása: 5 magas BMI-vel rendelkező beteg PET képét rekonstruáltuk meg az ajánlott gyári protokoll alapján, ezt követően 16 különböző képi rekonstrukciót végeztünk eltérő paraméterekkel. (Gauss filter, PSF, subset) A rekonstruált képek értékelése kvantitatív mérések és 3 független szakorvos diagnosztikai képminőséget jellemző véleménye alapján történt.
- Gyűjtési idő csökkentésének vizsgálata: 4 BMI csoportban 16 beteg PET képét elemeztük. Ezen betegek PET gyűjtése list módban történt, s az így kapott nyers adatokból modelleztük a rövidebb begyűjtési időt. Az így kapott képek diagnosztikus értékének véleményezése a rekonstrukciós módszertannal megegyezett. Az eredmények értékelése leíró statisztikával történt.
EREDMÉNYEK: 16 fajta rekonstrukciós algoritmus közül az I3S4PSFG rekonstrukció kapta a legmagasabb pontszámot a vizuális értékelést követően, ugyanezt a kvantitatív mérések is alátámasztották. A továbbiakban ezt a rekonstrukciót használtuk az időoptimalizációs vizsgálatokban. A javasolt gyűjtési idő BMI csoportonként eltérő volt. (BMI<25: 60 sec/frame; BMI 25-30: 75 sec/frame; BMI 30-40: 90 sec/frame; BMI>40: 120 sec/frame) Ettől sokkal kevesebb idő a képminőség romlását okozhatja, hosszabb idő viszont nem javítja nagymértékben a diagnosztikai értékét.
ÖSSZEFOGLALÁS: A vizsgálat során kiválasztott rekonstrukciós paraméter és a BMI-től függő begyűjtési idő került be a helyi protokollba.
6. A debreceni MiniPET kamerák leképzési tulajdonságai 10 évvel a telepítés után
1Kallos-Balogh Piroska, 1Vas Norman Félix, 1Opposits Gábor, 1Emri Miklós, 1Kiss János, 1Aranyi Csaba, 2Molnár József, 2Hegyesi Gyula, 3Imrek József, 1Balkay László
1Debreceni Egyetem, ÁOK, Orvosi Képalkotó Intézet
2 ATOMKI, Debrecen
3 Debreceni Egyetem, TTK, Fizikai Intézet
Célkitűzés: A Debreceni Egyetem és az ATOMKI együttműködésével, valamint jelentős hazai, illetve európai pályázati források bevonásával a 2000-es évek elején több miniPET rendszer kifejlesztése történt meg. Az egyetemen a preklinikai kutatások számára 2006-ban lett elérhető az első ilyen eszköz, a miniPET-2 kamera, illetve pár évvel később 2012-ben a korszerűbb detektorrendszert tartalmazó miniPET-3 készülék. Az eltelt 10 évben nem történt olyan alapvető módosítás a két PET rendszeren, amely a fizikai alaptulajdonságokat lényegesen befolyásolta volna, így célul tűztük ki, hogy kvantitatív módon analizáljuk a miniPET-2 és a miniPET-3 kamerák képalkotó képességeinek változását.
Módszer: Mindkét PET kamera egy 12 detektor modulból álló teljes gyűrűs PET rendszer. A detektorokban 1225 darab LYSO szcintillációs tűkristály (1,27 mm x 1,27 mm alapél és 12 mm magasság) foglal helyet, amelyek 35×35-ös mátrixba vannak rendezve. A két MiniPET rendszer között a fotoszenzorokban van a döntő különbség: a MiniPET-2 hagyományos PMT-ket, míg a MiniPET-3 esetén SiPM technológiát alkalmaz. A NEMA NU 4 nemzetközi PET szabványban előírt mérések segítségével a következő adatokat határoztuk meg: térbeli felbontás, a recovery coefficient (RC), uniformitás valamint az un. SpillOver Ratio (SOR) értéket. Mindezeket kiegészítve meghatároztuk a két kamera kristálypozíciónkénti energia felbontását is.
Eredmények: A térbeli felbontás átlagosan 20 %-kal jobbnak adódott a MiniPET-3 kamerán mérve, ami a miniPET2 kamera felbontásának romlásával is összefüggött. A képminőség fantom vizsgálat alapján a legkisebb átmérőjű rúd egyértelműen látható a MiniPET-3 képein, de már nem detektálható a minPET-2 képein. A SOR értékek hasonlónak adódtak a két rendszerre vonatkozóan (SOR levegő: ~0.15, SOR víz: ~0.25), miközben képi uniformitásban a MiniPET-2 adott rosszabb eredményt. Az RC értékek hasonlóak voltak a különböző rúdátmérőkre (∼0.3, 0.60, 0.83, 0.91, és 0.95), de szinte mindegyik érték magasabb volt a MiniPET-3 kameránál. A kamerák telepítése után a globális energiafelbontás 19.98% és 31.74% volt a miniPET-2 és a miniPET-3 esetén, az aktuális értékek a jelen vizsgálat szerint: 26.76% és 32.4%
Konklúzió: A debreceni MiniPET rendszerek továbbra is használhatóak kisállat vizsgálatokra, azonban a miniPET2 kamera a PMT-k, illetve valószínűleg az optikai csatolások öregedése miatt már egyértelműen gyengébb képalkotási tulajdonságokkal rendelkezik a miniPET3 rendszerhez képest. A rekonstruált képek minél jobb minősége érdekében folyamatosan elvégzett optimalizációkra és kalibrációkra van szükség.
7. Izotópos Szívizom SPECT Vizsgálatok Leképezési Paramétereinek Optimálása
Kári Béla1,2, Pártos Oszkár1, Leskó Vivien1, Seres László2, Forgács Attila2, Szlávecz Ákos3, Szűcs Ádám4, Györke Tamás1
1Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék. Budapest
2Mediso Ltd., Budapest
3BME Villamosmérnöki Kar Irányítástechikai és Informatikai Tanszék, Budapest
4ELTE Informatikai Kar, Komputer Algebra Tanszék, Budapest
Cél: A Single Photon Emission Computed Tomography (SPECT) leképezési eljárások egyik legnagyobb alkalmazási területe a szívizom perfúziós szcintigráfia. A szívizom szcintigráfiát számos torzító és zajhatás terheli, amely szignifikáns hatással van a képminőségre, és a diagnosztikai megbízhatóságra. Intézetünkben kialakításra került a transzlációs kutatólaboratórium, melynek zászlóshajója az AnyScan™ Trio-SPECT/CT/PET (SCP) tripla modalitású rendszer számos új leképező geometria lehetőségeivel. Főtevékenységünk részeként célként tűztük ki a szívizom szcintigráfia optimálását a Trio-SPECT/CT leképezéssel. Irányadó szempontok a vizsgálatok időtartama és képminősége volt, azaz mely leképezési idővel nem tapasztalható még diagnosztikai értéktorzulás.
Módszer: A szívizom SPECT vizsgálatok az SCP rendszerrel 3-detektoros parallel Low Energy High Resolution High Sensitivity (LEHRHS), valamint Multi-PinHole Cardiac (MPH-C) kollimátorral készültek. A referenciát az AnyScan™ SC (SPECT/CT) dual-detektoros berendezés szolgáltatta a rutinban alkalmazott LEHR kollimátoros párhuzamos vizsgálattal – az MPH-C leképezésnél minden alkalommal – rutin eljárással. A parallel vetítéssel mind a perfúziós, mind az ECG kapuzott metodikák a módszertan alanyai voltak, míg az MPH-C leképezésnek csak a perfúziós vizsgálatok. Mivel az SCP rendszer rendelkezik LIST (folyamat mintaregisztrátum) adatfelvételi eljárással így e módszerrel „elegendő hosszú” idejű mintaregisztrátumot (kellő jel/zaj viszony, 16min÷20min.) rögzítettünk. A LIST regisztrátumból retrospektív módon előállítható a LIST adatgyűjtésnél rövidebb idejű FRAME sorozat à „LIST-FRAME Conversion”, amely a meglévő képfeldolgozási eljárásokkal rekonstruálható. A LIST-FRAME konverzió által paraméterezett FRAME „raw” képadat generálható, s oly FRAME kép sorozatot produkál, mintha direkt FRAME adatfelvételt a konverzió során alkalmazott paraméterek deklarálása eredményezne. Így a szívizom perfúziós vizsgálatok a valódi zoom, diszkretizáció fok (64, 128,…), azaz pixelméret, FRAME időtartam, kapuzási időablak (8, 16,…) által paraméterezhetőek. A mintaregisztrátum szög szerinti mintavétele viszont nem, azt a LIST adatgyűjtés során kell megfelelően deklarálni. Az SCP rendszerben parallel vetítéssel 360 fok (120fok detektorállással) 96 lépéssel történt az adatfelvétel, míg MPH-C kollimátor esetén stationary -nem mozgó detektor állású- állapotban. A különböző FRAME paraméterekkel nyert „raw” adathalmazon TeraTomo Q képrekonstrukciós eljárás szolgáltatta a képi eredményt. A CT-vel nyert anyageloszlás térképpel a CT-AC alapú csillapítás korrekció és Monte-Carlo szórás korrekció (MC-SC, -Medium Level-) valósult meg.
Eredmények: E lehetőségek tükrében a 4min. időtartamtól (alsó határ) 16min. időtartamig található oly paraméterhalmaz, mely megfelelő diagnosztikai eredményt szolgáltat. A LIST-FRAME konverziónál alkalmazott paraméterek egy ugyanazon leképező rendszeren belül közvetlenül felhasználható a direkt FRAME rutin adatfelvételekhez. Az adatok első közelítésű elemzését követően azt kaptuk az SCP rendszerre, hogy 10÷12min. felvételi idővel megbízható diagnosztikai értékű szívizom vizsgálat végezhető. Hasonló eredményt szolgáltat az MPH-C leképezés is. E képalkotás további kutatása, fejlesztése a beáramlás, a 4D felvételi és rekonstrukciós metodikára irányul.
8. 3D nyomtatott antropomorf szívfantom nukleáris medicina alkalmazásokhoz
Kiss János 1, Balkay László 2, Kukuts Kornél 3, Mikó Márton 2, Forgács Attila 3,4, Trencsényi György 2, Krizsán Áron Krisztián 3
1Debreceni Egyetem, KK, Orvosi Képalkotó Klinika, Radiológia
2Debreceni Egyetem, ÁOK, Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék
3ScanoMed ScanoMed Orvosi, Diagnosztikai, Kutató és Oktató Kft.
4 Mediso Medical Imaging Systems Kft.
Bevezetés: A SPECT és PET rendszerek képminőség ellenőrzéséhez gyakran alkalmaznak antropomorf törzsfantomokat, melyek különféle szív-inzerteket tartalmazhatnak. Ezek a szívfantomok általában egyszerűsített geometriával rendelkeznek. A 3D nyomtatás azonban megnyitotta az utat, a pontos anatómiával rendelkező, feltölthető fantomok gyors és költséghatékony gyártásához. Az előadás során bemutatásra kerülnek általunk, valós páciensadatból szegmentált, 3D nyomtatott, feltölthető, antropomorf balkamrai szívizom fantomok, illetve az elkészítéséhez szükséges munkafolyamat.
Anyag és módszer: Egy egészséges, felnőtt férfi gyengítés-korrigált 18F-FDG PET felvételéből bal szívkamrája került kiszegmentálásra. A szegmentált modellből két eltérő típusú fantom készült, egy egészséges és egy kamrai defektusos, melyeket szálhúzásos technikával polietilén-tereftalát glikol filamentből 3D nyomtattunk ki. Vizsgáltuk az előállítási reprodukálhatóságot, továbbá 99mTc-SPECT/CT vizsgálatokat végeztünk az elkészült inzerteken. Mindkét típust mértük csak levegőben, egyéb szóró közeg nélkül, illetve az egészséges fantomot behelyeztük a DataSpectrum antropomorf torzó fantomjába, feltöltött máj és háttér aktivitások mellé.
Eredmények: A fantomokat egyszerűen, szivárgás és buborék nélkül, köszönhetően a kialakított buborékcsapdának, fel lehetett tölteni és lezárni. Az inzertek teljesen kompatibilisek a használt törzsfantommal. A levegőben végzett mérések 17 szegmenses polártérkép-elemzése kimutatta, hogy az eloszlásban jelentős hiány jelent meg a defektusos modellnél. A polártérkép szegmensek 59%-ában a torzóban és a levegőben végzett mérések összehasonlításakor az eltérés kevesebb, mint 5% volt. A hiányos területet leszámítva egyik összehasonlítás sem mutatott 12,4%-nál nagyobb eltérést. Mindhárom polártérkép hasonló apikális régióértékeket mutatott.
Következtetés: Az elkészült antropomorf, 3D nyomtatott szívfantomok nagy pontossággal és reprodukálható módon előállíthatók. A fantomok, különböző feltétlek mellett, alkalmasnak bizonyultak SPECT képminőségi vizsgálatokra. Az előadásban bemutatásra kerülő 3D nyomtatási eljárás rugalmassága lehetővé teszi skálázható, anatómiailag pontos fantomok létrehozását a nukleáris kardiológiai képalkotás számára.
9. Manuális és automatikus mozgáskorrekció hatása kisgyermekek kamera-renográfia vizsgálatainak eredményeire
Czékus Tamás, Urbán Szabolcs, Besenyi Zsuzsanna, Német Rita, Farkas István, Sipka Gábor, Bakos Annamária, Mikó Zsófia, Nagy Szanella, Pávics László
Szegedi Tudományegyetem Nukleáris Medicina Intézet
Bevezetés: A technécium-99m dietilén-triamin-pentaecetsav (99mTc-DTPA) kamera-renográfia széles körben elérhető diagnosztikai módszer a szeparált vesefunkció és az urodinamika értékelésére. A vizsgálatok helyes értelmezéséhez elengedhetetlen a megfelelő háttér és a vese kontúrok kiválasztása. A beteg mozgása jelentősen befolyásolja az eredményeket. Tanulmányunk célja az volt, hogy megvizsgáljuk a manuális és automatikus mozgáskorrekciós algoritmusok hatékonyságát a vizsgált paraméterekre.
Anyag és módszer: 360 dinamikus renográfiából 14 csecsemő (életkor: 5 hónap -7 év; férfi: 8, nő: 6) vizsgálatát értékeltük újra. Mindegyik esetben a hagyományos technikával a gyermekek nyugtalansága miatt nem lehetett megfelelő időaktivitási görbéket kapni. Az automatikus mozgáskorrekcióra és a renogram görbék előállítására egy saját fejlesztésű módszert alkalmaztunk, amely a képkockák páronkénti regisztrálásán alapul. A manuális korrekció során a képkockákat csak vízszintesen és függőlegesen mozgattuk, hogy a vesék a képsorozaton azonos pozícióban legyenek. Az automatikus korrekció a vízszintes és függőleges mozgások mellett szükség szerint elforgatta a képkockákat. A renográfia görbe paramétereinek különbségeit összehasonlítottuk, és a szignifikanciát Wilcoxon-teszttel határoztuk meg.
Eredmények: A kézi mozgáskorrekció betegenként 15 percet vett igénybe, míg az automatikus változat csak 1 percet. Mindkét korrekciós módszerrel megfelelő időaktivitási görbéket kaptunk, melyeket kiértékeltünk. Manuális korrekció során a T-max (átlag ± SD) 8,48 ± 6,65 perc, a T1/2: 9,75 ± 6,72 perc lett, míg az automatikus korrekcióval 8,6±6,87 perc és 10,02±6,94 perc értékeket kaptunk. A vizsgált két módszer közötti különbségek nem voltak szignifikánsak (p=0,90 és 0,82). A bal és jobb vesék relatív funkcióit vizsgálva a manuális mozgáskorrekcióval 50,1±5,01%; 49,9±5,01%, míg az automatikus módszerrel számolt értékek 50,46±4,55%; 49,54±4,55% lettek. Ezen különbségek esetében sem találtunk szignifikánsnak bizonyuló különbséget (p=0,71 és 1,0). Az időaktivitási görbeparaméterek meghatározása mellett, mindkét módszer segítette a képek vizuális értelmezését is.
Következtetés: Mind a manuális, mind az automatikus mozgáskorrekciós módszer eredményesen segítette a nyugtalan csecsemők esetében a radiorenográfia kiértékelését, de az automatikus korrekció számottevően gyorsabbnak bizonyult.
10. Fél-automatikus szervszegmentáló SPECT/CT képeken
Urbán Szabolcs1, Rácz Viktória2, Besenyi Zsuzsanna1,, Pávics László1
1Szegedi Tudományegyetem, Nukleáris Medicina Intézet, Szeged
2Szegedi Tudományegyetem, Informatikai Intézet, Szeged
Bevezetés: Kvantitatív elemzések során gyakran szükséges kijelölni egy adott szerv pontos háromdimenziós térfogatát, pl. szervdózisok számolásához, páros szervek közötti aktivitás különbségek kvantifikálásához. A szerv méretétől és elhelyezkedésétől függően a kézi, szeletről-szeletre történő kijelölés igen időigényes feladat lehet. Célunk egy olyan módszer kifejlesztése volt, amely egy adott szerv kijelölését teszi lehetővé rövid idő alatt (1 perc). A pontosabb kijelölés érdekében a módszer képes egyszerre felhasználni az anatómiai és a funkcionális információt adó képeket (pl. SPECT/CT).
Anyag és módszer: A módszer lényege, hogy egy felhasználó által megadott pontból kiindulva több, egyre kiterjedtebb szervkontúr kerül kijelölésre (ún. Fast Marching algoritmus segítségével), amelyek közül a felhasználó kiválaszthatja a számára legmegfelelőbbet(egy csúszka segítségével). A szerv kijelöléséhez a módszer egy speciálisan fúzionált képet hoz létre, amely kiemeli az anatómiai képen látható szervhatárokat, valamint a funkcionális kép homogén (szerv) régióit. Az eredmények validálása 13 beteg SPECT/CT felvételeinek felhasználásával történt(99mTc- tectrotide SPECT és 99mTc-PSMA SPECT). A máj, vese és hólyagkontúrok kijelölését egy szakorvos először kézzel, majd a fél-automatikus módszer segítségével is elkészítette. Az így készült fél-automatikus eredményeket Dice metrika segítségével hasonlítottuk össze a kézzel készített szervkijelölésekkel.
Eredmények: A módszerrel készült szervkontúrok minden esetben 90% feletti pontossággal készültek el, egy percen belül. A kézi kijelölés máj esetében tíz-húsz percet igénybevevő feladat is lehet. Négy esetben a máj és a jobb vese a SPECT intenzitások alapján nem volt elkülöníthető. Ezekben az esetekben először a bal vese került kijelölésre, majd a módszer ezt felhasználva a jobb vesét és a májat is sikeresen kijelölte.
Következtetés: Egy új, fél-automatikus módszer került bemutatásra, amely egy adott szerv gyors kijelölését teszi lehetővé SPECT/CT képek együttes felhasználásával. A kiértékelések alapján a szervszegmentáló segítségével gyors és nagy pontosságú szervszegmentálások érhetőek el.
11. Automatikus bordacimkézés SPECT/CT és PET/CT felvételeken
Urbán Szabolcs1, Besenyi Zsuzsanna1,, Pávics László1
1Szegedi Tudományegyetem, Nukleáris Medicina Intézet, Szeged
Bevezetés: Egy adott borda azonosítása alapvető, de időigényes feladat a klinikai rutin során. A bordák meghatározásához gyakran a csigolyák azonosítására is szükség lehet. Célunk egy olyan módszer kifejlesztése volt, amely automatikusan kijelöli és felcimkézi a bordákat alacsony dózisú CT felvételeken. Az így készült bordakijelölések felhasználhatóak a CT-vel fúzionált funkcionális vizsgálatok(SPECT, PET) értékeléséhez is.
Anyag és módszer: Az automatikus módszer 4 fő lépésből áll: 1) csontszövet szegmentálása; 2) tüdő szegmentálása; 3) gerinc szegmentálása a tüdő melletti csontszöveten belül; 4) bordák kijelölése a csigolyákból induló csontszöveteken. Az eredmények validálása 10 beteg 99mTc-MDP SPECT/CT, 18F-FDG PET/CT felvételeinek felhasználásával történt. A bordacimkéző teljesen automatikusan jelölte ki a bordákat. Az így készült eredményeket szakorvos értékelte.
Eredmények: A módszerrel készült bordakijelölések 85% feletti pontossággal készültek el, átlagosan 12 másodperc alatt. Leggyakrabban az első vagy az utolsó bordák kijelölése/cimkézése volt sikertelen. A vizuális azonosítást azonban így is megkönnyítette a bordák nagy többségének kijelölése.
Következtetés: Egy új, automatikus módszer került bemutatásra, amely a bordák gyors kijelölését teszi lehetővé CT képek felhasználásával. A kiértékelések alapján a cimkéző segítheti a bordák gyors és pontos azonosítását.
12. MultiPinHole kollimátor technikai előnyei DaTscan SPECT/CT vizsgálatokban.
Budai Ádám1, Garai Ildikó1, Kukuts Kornél1, Forgács Attila1, Barna Sándor1
1 ScanoMed Kft. Nukleáris Medicina Központ, Debrecen
Bevezetés: A I-123 Ioflupane egy olyan radiofarmakon, amelyet a Parkinson-szindróma (Parkinson-kór, multiszisztémás atrófia, progresszív szupranukleáris parézis) elkülönítésére használnak a hasonló klinikai tüneteket mutató esszenciális tremor valamint gyógyszer-indukálta parkinsonizmus kórképeitől. Korábbi, elsősorban fantomokkal végzett vizsgálatok rámutattak, hogy a „kis” szervek célzott vizsgálatára fejlesztett MultiPinHole (MPH) kollimátor használata, DaTscan esetében jelentős minőségbeli előnyökkel jár.
Célunk annak felmérése, hogy a MPH kollimátorral végzett DaTscan SPECT vizsgálatok gyűjtési ideje csökkenthető-e a diagnosztikai képminőség megtartásával.
Anyag és módszer: 29 betegeknél 185 MBq I-123 Ioflupane (DaTscan) iv. injekció beadása után 3 óra múlva LIST módú SPECT adatgyűjtést végeztünk MPH kollimátorral felszerelt AnyScan TRIO SPECT/CT (Mediso) kamerán (72 view 75 sec, helical elmozgás 40 mm, Matrix méret: 256×256; CT: 120kV, 50mAs).
A csökkentett gyűjtési időt következőképpen modelleztük: LIST módú képeket újra mintavételeztük 37 másodperc képidővel. Mindkét esetben Tera-Tomo 3D SPECT Q CT attenuáció korrigált rekonstrukciót alkalmaztunk, a rövidebb gyűjtési idejű képek esetén kevesebb iterációs számmal (36 vs 18 iteráció).
A rekonstruált SPECT képeket a Pinax Pharma (Brandenburg Germany) által fejlesztett easyDATTM rendszerrel elemeztük. Az eredménylapokat randomizáltuk és 5 szakorvos vizuálisan („vakon”) értékelte a képeket úgy, hogy az összetartozó vizsgálatokról nem tudhatta milyen képidővel készültek.
Eredmények: Az egyes értékelők között szignifikáns eltérések voltak a grádus meghatározásában (Friedman P <0,001), azonban érdemi különbség az egészséges (grade 0) és kóros (grade 1-3) vizsgálatok elkülönítésében nem jelentkezett (Wilcoxon próba P >0,1). Az egész és félidős képek elemzése során, az adott képpárok vonatkozásában az értékelő orvosok pontszámai között, sem összessítve sem egyénenként nem mutatkozott szignifikáns különbség (Wilcoxon próba P >0,1).
Következtetés: Eredményeink alapján a MPH kollimátor használata DaTscan SPECT/CT vizsgálat során lehetőséget ad a vizsgálati idő és/vagy az injektált aktivitás jelentős csökkentésére, megőrzött diagnoszikai pontosság mellett, mellyel vagy vizsgálati idő, vagy sugárterhelés csökkentés érhető el.
13. Új multi-pinhole kollimátor és háromdetektoros SPECT technika képminőségének tesztelése nukleáris kardiológiai applikációkhoz
Krizsán Áron Krisztián1, Kukuts Kornél1,2, Al-Muhanna Walid2, Szoboszlai Zoltán1, Balázs László2, Kiss János3, Mester János4, Stephan Nekolla5, Bükki Tamás2, Barna Sándor1,2, Garai Ildikó1,2, Forgács Attila1,2
1ScanoMed Kft, Debrecen
2Mediso Kft., Budapest
3Debreceni Egyetem, Orvosi Képalkotó Klinika
4Universitätsklinikum Hamburg-Eppendorf, Hamburg
5Technische Universität München and DZHK (German Centre for Cardiovascular Research), Munich
Bevezetés: A hagyományos párhuzamos furatú (LEHR) kollimátorral rendelkező SPECT képminőségét mindeddig limitálta a technika viszonylagosan alacsony tomografikus érzékenysége és térbeli felbontása. Ezen korlátok kiküszöbölésére több innovatív megoldás is született, beleértve olyan dedikált karidológiai SPECT készülékeket, amelyek a több vetületű ú.n. multi-pinhole leképzést alkalmazzák. Jelentős képminőségbeli javulás érhető el a multi-pinhole cardiac (MPH-C) wolfram apertúrát használó, háromdetektoros SPECT leképzéssel (Mediso AnyScan SC TRIO) a hagyományos kétdetektoros LEHR kollimátoros SPECT-hez képest. Ez a javulás az MPH-C technológia által a myocardium régiójában szolgáltatott kiváló tomografikus érzékenységének és jobb térbeli felbontásának tulajdonítható. Ebben a tanulmányban az MPH-C kollimátor képalkotási képességeit vizsgáltuk háromfejes SPECT/CT-rendszeren fantom-mérésekkel és egyetlen páciens leképzésével.
Anyag és módszer: Tomográfiás érzékenységet a látómező kritikus pontjait lefedő centimeter skálára helyezett 99mTc pontforrással (TSpointsource) mértük, és ugyanezt a mérést használtuk a térbeli felbontás értékelésére. A szív méretre számolt tomografikus érzékenységet (TSorgan) a DataSpectrum antropomorf balkamra (LV) fantom segítségével mértük, amelyet betegvizsgálatra jellemző aktivitáskoncentrációval töltöttünk fel. A képi uniformitás meghatározásához egy 14 cm átmérőjű hengerfantomot használtunk. Az először 99mTc-vel, majd 123I-vel feltöltött antropomorf szívfantom segítségével polarmap analízist végeztünk, spill-over-ratio-t (SOR) és pixel varianciát számoltunk. Ezen eredményeket összevetettük a kétfejes SPECT és párhuzamos furatú (LEHR) kollimátor rendszeren mért értékekkel. Továbbá összehasonlítottuk egyetlen páciens 16 perces gyűjtési idejű LEHR és 4 perces MPH-C felvételét.
Eredmények: A TSpointsource csúcsértéke 1013 cps/MBq-nek adódott a FOV tengelyirányú középpontjában, míg a sugárirányú szélek felé drasztikusan csökkent. A TSorgan a CFOV-ban 134 counts/sec/MBq és 700 counts/sec/MBq volt a LEHR és az MPH-C esetében. Az abszolút átlagos térbeli felbontás 4,4 mm FWHM-nak adódott. A képegyenletesség értéke 0,504 %, illetve 0,392 % volt a LEHR és az MPH-C mérések esetében. A polarmap elemzés 28,83%-os és 21,1%-os SOR-értékeket adott 99mT-ra, míg a 123I esetében ugyanez 31,44% és 24,33% volt az LEHR és a MPH-C esetében. A 99mTc polarmap pixel-szintű zajának értéke 0,38 %-nak és 0,24 %-nak, míg 123I-ra 0,62 %-nak és 0,21 %-nak adódott a LEHR és az MPH-C esetében. A betegvizsgálati képek vizuális értelmezése során az MPH-C jobb képkontrasztot eredményezett a LEHR mérésekhez képest, négyszer rövidebb vizsgálati időtartam mellett.
Következtetés: Jelentős jobb képminőség érhető el a kombinált MPH-C és háromdetektoros SPECT technikával, a hagyományos LEHR kétfejes SPECT leképzéshez képest. Az új MPH-C apertúra által biztosított kiváló tomografikus érzékenység lehetővé teszi a rövidebb adatgyűjtési időt vagy az alacsonyabb effektív dózist a képminőség romlása nélkül, mind perfúziós mind innervációs SPECT applikációk esetén.
2022. május 20. péntek, 10:00 – 11:00, Asszisztens továbbképzés
1. Mire a humán vizsgálat rutin lesz. A kutatás jelentősége.
Trencsényi György
Debreceni Egyetem, ÁOK, Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék
A transzlációs medicina vagy más néven transzlációs kutatás képezi a hidat az alapkutatások és a klinikai alkalmazások között. Magában foglalja az alapkutatások humán terápiákban alkalmazható hatásvizsgálatát, a betegségek biológiai vizsgálatát, a humán betegségek kezelésének új fejlesztéseit, olyan nem humán és nem klinikai vizsgálatokat, amelyek az alapját képezhetik új klinikai alkalmazásoknak, valamint idetartoznak a gyógyszerfejlesztés egyes klinikai fázisának vizsgálatai. Ebben a folyamatban van helye és kiemelkedő jelentősége az úgynevezett transzlációs képalkotásnak, amelynek köszönhetően kifejlesztett képalkotó technikák, jelölőanyagok, kiértékelő módszerek könnyebben és hamarabb átültethetők a klinikai gyakorlatba. Egy új – akár radionukliddal jelölt – molekula humán szervezetben történő vizsgálatát preklinikai kutatásoknak, vizsgálatoknak kell megelőznie, amely alapján eldönthető, hogy az adott jelölt molekula alkalmas-e a további – humán – vizsgálatokra adott formájában. A preklinikai vizsgálatok többek között magukban foglalják a jelzett molekula in vitro sejtes rendszereken, illetve az in vivo állatmodelleken történő vizsgálatát. Sajnos, még ma sem rendelkezünk olyan in vitro molekuláris biológiai módszerekkel, amelyek segítségével a különböző (például daganatos) megbetegedések lefolyásának minden aspektusát vizsgálni tudjuk (elsősorban igaz ez például a tumorok metasztatizáló képességére), illetve az in vitro vizsgálatok a radioaktívan jelzett molekulák, gyógyszermolekulák az élő szervezetre gyakorolt hatását, szervezeten belüli megoszlását, anyagcsere- folyamatokba történő kapcsolódását nem tudják tökéletesen modellezni. Ezekhez a vizsgálatokhoz in vivo kísérletekre, állatmodellekre, állatkísérletekre van szükség. A preklinikai vizsgálatok során egy radionukliddal jelölt molekula szervezeten belüli időbeni eloszlását modern, nem invazív képalkotó berendezésekkel vizsgálhatjuk kvantitatív módon. Ennek megfelelően igen nagy ütemben indultak fejlődésnek a kisállat-PET és -SPECT-kamerák, amelyek már a kis laboratóriumi állatok (egér, patkány) vizsgálatához szükséges milliméteres, illetve az alatti felbontóképességgel rendelkeztek. A kisállat PET/CT hibrid képalkotó technológia forradalmi változásokat hozott az onkológiai, kardiológiai és neurológiai kutatásokban. E fejlődésnek adtak újabb lendületet és jövőbeni iránymutatást a preklinikai PET/MRI berendezések, illetve a legújabb fejlesztésű SPECT/MRI készülékek. E hibrid képalkotó berendezéseknek köszönhetően ugyanazon kísérleti állat többször vizsgálható, ezáltal nincs szükség az állat terminálására ahhoz, hogy kvantitálható információhoz jussunk a jelzett molekula adott idő alatt történő szervezeten belüli eloszlásáról. Lehetővé válik az élettani, kórélettani folyamatok hosszútávú követése, a kezelések hatékonyságának kimutatása. A preklinikai képalkotó berendezések alkalmazásával csökkenthető a kísérleti állatok száma, továbbá noninvazív tulajdonságukból adódóan eleget tesznek az állatkísérletekkel szemben elvárt „3R” stratégiának, amely megköveteli a kísérleti állatok számának redukálását, valamint a kezelésük technikáinak finomítását. E modern hibrid készülékek, valamint a mögöttük álló úgynevezett gyűjtő és képrekonstrukciós szoftverek fejlődésével egyre pontosabb, értékelhetőbb felvételeket kapunk a kisállatokban zajló fiziológiás és patológiás folyamatokról. A módszer érzékenységének, felbontásának növelésével egyre alacsonyabb injektálandó dózisokra van szükség, valamint rövidül a gyűjtési, vizsgálati idő, amelyek szintén olyan tulajdonságai e modern képalkotó eszközöknek, amellyel csökkenthető a kísérleti állatot érő stressz. A molekuláris biológia fejlődésével újabb és újabb molekuláris célpontok, targetek jelennek meg, aminek köszönhetően az eddig gyakran használt és többnyire nem specifikus (például: 18FDG) radiofarmakonok mellett felmerült az igény új, specifikus molekulák iránt. A PET, illetve SPECT leképezésre alkalmas radionuklidokkal jelzett új targetspecifikus molekulákkal jól monitorozhatók a receptor-targetált terápiák, génterápiák és megteremtik az alapjait az úgynevezett „theranostics” alkalmazásoknak, új utakat nyitva a preklinikai képalkotásban. Mindezeknek köszönhetően a preklinikai képalkotó berendezések alkalmazásával a sokszor igen hosszú és költséges gyógyszerkutatás, gyógyszerfejlesztés folyamata lerövidíthető, költségei csökkenthetők.
2. Ritka vizsgálatok a nukleáris medicinában – technikai nehézségek és kihívások
Patkó Zsófia Panna, Gombos János
BAZ Megyei Központi Kórház és Egyetemi Oktatókórház Miskolc
A nukleáris medicina vizsgálatok a képalkotó diagnosztika speciális ágát képviselik. A hétköznapi rutin feladatok mellett gyakran találkozhatunk olyan vizsgálatokkal, melyekre csak ritkán, esetleg csak évi egy-két alkalommal kerül sor. Emiatt ezeknek a vizsgálatoknak a szervezése, kivitelezése és értékelése kihívást jelenthet. Előadásomban a ritka vizsgálatokra, elsősorban azok technikai kihívásaira, buktatóira szeretném felhívni a figyelmet.
A technikai beállításokat a Magyar Orvostudományi Nukleáris Társaság (MONT), az Európai (EANM) és Amerikai (SNMMI) nukleáris medicina társaságok közleményei illetve iránymutatásai mentén tekintjük át, felhasználva az osztályunkon ( BAZ Megyei Kórház és Egyetemi Oktatókórház, Nukleáris Diagnosztikai és Terápiás Osztály) szerzett tapasztalatokat illetve a releváns szakirodalmat.
Egyes nukleáris medicina vizsgálatokra a betegség előfordulása miatt kerül ritkán sor. Más esetekben az izotópos képalkotás nem elsődleges a kivizsgálási procedúrában, vagy alternatív lehetőségek is vannak a leképezésre. A radiofarmakon elérhetősége is korlátozhatja a vizsgálatok számát. Hasonló a helyzet új fejlesztésű radiofarmakonok vagy a klinikai gyakorlatba még be nem épült eljárások esetén. Jelen előadásomban néhány relatíve ritka, a hétköznapi rutinban kevéssé reprezentált vizsgálat típust mutatok be, különös tekintettel azok technikai nehézségeire, mint pl. a könnymirigy ill. nyálmirigy szcintigráfia, limfoszcintigráfia, shunt-ök detektálása, CSF shunt-ök diagnosztikája, DAT scan, hereszcintigráfia, kvantitatív tüdőszcintigráfia, gyermekkori vizsgálatok, szív MIBG, illetve szív amyloidosis vizsgálatok.
Következtetés (Conclusion): A ritkábban előforduló vizsgálatok esetén fontos a klinikai kérdés, pontos anamnézis ismerete. A radiofarmakon farmakokinetikája és az izotóp fizikai tulajdonságai alapvetően meghatározzák a leképezés paramétereit. Klinikum függvényében változhat a vizsgálat jellege, dinamikus illetve statikus vizsgálat szükségessége. A kamera beállításainál figyelni kell a megfelelő adatgyűjtésre, vizsgálat tervezésére. Egyes esetekben a beteg pozícionálása is eltérhet a szokásostól. A fentiek tekintetében a szakmai protokollok jó iránymutatást adnak. Speciális csoportot alkotnak a gyermekkori vizsgálatok, mivel gyermekekben eltérő lehet a normál eloszlás, illetve a gyermekek speciális előkészítést igényelhetnek a vizsgálatokhoz.
2022. május 20. péntek, 14:00 – 15:00, Klinikum III.
1. Halmoz és dúsít is? – Az egy ülésben végzett FDG-PET/CT és kontrasztanyagos nyaki CT vizsgálat jelentősége a fej-nyaki daganatok diagnosztikájában
Kristóf Emese1, Sükösd Hunor2, Laczkó Katalin1, Kiss Eszter1, Albert Orsolya1, Szántó Péter1, Horváth Angéla3, Dános Kornél3, Prekopp Péter3, Czibor Sándor1, Varga Zsolt1, Györke Tamás1
1Semmelweis Egyetem Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
2Semmelweis Egyetem Orvosi Képalkotó Klinika, Radiológia Tanszék, Budapest
3Semmelweis Egyetem Fül-Orr-Gégészeti és Fej-Nyaksebészeti Klinika, Budapest
Bevezetés: A fej-nyaki tumorok megfelelő terápiájának kiválasztásához elengedhetetlen az optimális képalkotó diagnosztika. A különböző modalitásoknak eltérő a szenzitivitása és specificitása a stádiumot meghatározó pathologiás eltérések megítélésében. A residualis betegség vagy recidíva jelenlétének megállapításában is sok szempontból egymást kiegészítő adatokat szolgáltatnak. A 18F-fluorodezoxiglükóz pozitron emissziós tomográfia/komputertomográfia (PET/CT) jelentősége egyre nagyobb ezekben a kérdésekben, az American College of Radiology által bevezetett Neck Imaging Reporting and Data System-ben (NI-RADS) is állandó szerephez jut. Jelen előadásunkban azt vizsgáljuk meg, hogy a fej-nyaki daganatok pontos diagnosztikájában a PET/CT és a kontrasztanyagos CT (CECT) által nyújtott információk hogyan egészítik ki egymást, valamint hogy milyen előnyei lehetnek a két vizsgálat egy ülésben történő elvégzésének.
Anyagok és módszerek: A Semmelweis Egyetem Orvosi Képalkotó Klinika Nukleáris Medicina Tanszékén (SE OKK NMT) 2017 óta több, mint 400 fej-nyaki daganatos pácienst vizsgáltunk. Közülük 94 esetben állt rendelkezésre részletes klinikai dokumentáció és készült staging vagy restaging vizsgálat PET/CT-vel és CECT-vel. Ezekből 23 esetben egy ülésben, 71 esetben külön ülésben (egymáshoz képest 2 hónapon belül) történt meg a képalkotás. A pácienseknél az egyes modalitások által nyújtott stádiumot és terápiát meghatározó diagnosztikus információkat dolgoztuk fel, ezek pontosságát a klinikai és műtéti szövettan függvényében értékeltük. Az egy ülésben végzett PET/CT és CECT vizsgálatok esetén elemeztük, hogy az eljárás mennyivel növelte a vizsgálat szenzitivitását és specificitását, és hogyan befolyásolta a kezelésig eltelt időt.
Eredmények: A populáció elemszámát jelentősen csökkentette a külön elvégzett vizsgálatok között eltelt hosszú idő, mely a stádiumot és következményesen a prognózist befolyásolja. A vizsgálatba bevont, még összehasonlíthatónak ítélt külön készült, valamint az egy ülésben elvégzett PET/CT biológiai, és a CECT anatómiai szenzitivitása gyakran mind a tumor, mind a nyirokcsomók stádiumának meghatározásában egymást kiegészítették. Mindkét képalkotóval több esetben előfordult lokoregionalis upstaging, melyet szövettani vizsgálat verifikált. A PET/CT vizsgálat ismert szerepe a távoli áttétek és második primer malignitás kimutatásában a vizsgált populáció 17%-ában módosította a terápiás tervet vagy további célzott kivizsgálás alapja volt. Szintén előfordult, hogy egyéb, a terápiát befolyásoló (leginkább fertőzéses) tény került felfedezésre. Az egy ülésben elkészült PET/CT és CECT vizsgálat átlagosan 1 hónappal rövidítette meg a terápiáig eltelt időt.
Konklúzió: Az onkológiában a minél gyorsabb és pontosabb diagnosztika és ellátás egyértelműen javítja a betegek prognózisát. A vizsgált két modalitás együttesen számottevően pontosabb staginget eredményez, egy ülésben való elvégzésük pedig a kezelésig eltelt időt rövidíti le. Sok esetben egyéb terápiás konzekvenciával bíró kóros folyamatra is csak így derül fény. Ez alapján elmondható, hogy jelen metodika rutin, széleskörű alkalmazása a fej-nyak onkológiai ellátás optimalizálásához vezet, így mindenképp javasolható.
2. Benignus és malignus eredetű emésztőrendszeri dúsulások elkülönítése 18F-FDG PET/CT-vel.
Dezső Dániel, Zámbó Katalin, Ritter Zsombor, Bán Zsuzsanna, Szabó Zsuzsanna, Schmidt Erzsébet
Pécsi Tudományegyetem Klinikai Központ, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Pécs
Bevezetés: A vastag- és végbélrák az egyik leggyakoribb rosszindulatú daganat a nyugati világban. A PET/CT vizsgálatok során egyéb daganatok mellett is gyakran látunk bélrendszeri fokális FDG-dúsulást. Vizsgálatunk célja az volt, hogy találjunk olyan kvantitatív 18F-FDG PET-paramétert, amely alkalmas lehet a malignus és benignus eredetű gasztrointesztinális dúsulások elkülönítésére.
Anyag és módszer: 2016. júniusa és 2017. januárja között végzett 560 18F-FDG PET/CT vizsgálat képanyagát tekintettük át. A PET/CT vizsgálatokon látott és további vizsgálatra javasolt gyomor-bélrendszeri dúsulásokat összehasonlítottuk az endoszkópos és kórszövettani leletekkel. A körülírt dúsulások konvencionális és texturális PET-paramétereit Interview Fusion szoftverrel (Mediso) értékeltük, a statisztikai elemzésre SPSS szoftvert használtunk. A konvencionális paramétereket (pl. SUVmax) a máj aktivitással is korrigáltuk.
Eredmények: Az áttekintett vizsgálati anyagból 44 betegnél (23 nő, átlagéletkor 58±9 év és 21 férfi, átlagéletkor 60±14 év) álltak rendelkezésre endoszkópos eredmények, akik közül 8 metforminnal kezet 2-es típusú cukorbeteg volt. Összesen 56 fokális FDG dúsulást értékeltünk, melyek közül 10 esetben a szövettan rosszindulatú folyamatot talált, a többi esetben gyulladásos és egyéb jóindulatú GI elváltozás igazolódott. Eredményeink alapján a korrigált (p<0,001; r=0,519,p<0,001) és nem korrigált (p<0,001; r=0,499,p<0,001) SUVmax értékek és az entrópia (p<0,05; r=0,301,p<0,05) szignifikánsan magasabb volt a rosszindulatú daganatokban, ami korrelált a szövettani leletekkel. Nem volt szignifikáns különbség a rosszindulatú és jóindulatú elváltozások homogenitása (p=0,164) és intenzitás variabilitása (p=0,211) között. Beteganyagunkon a ROC analízis alapján a rosszindulatú elváltozások elkülönítésére az optimális határérték a SUVmax>13,0 (szenzitivitás 70,0%, specificitás 97,7%).
Következtetés: Eredményeink alapján, más tanulmányokhoz (2, 3) hasonlóan, a SUVmax lehet a leghasználhatóbb konvencionális PET-paraméter a gasztrointesztinális rendszerben előforduló körülírt FDG dúsulások megkülönböztetésére, a texturális PET-paraméterek közül az entrópia lehet még erre alkalmas.
Hivatkozások:
- A TKP2021-EGA-10 számú projekt az Innovációs és Technológiai Minisztérium Nemzeti Kutatási Fejlesztési és Innovációs Alapból nyújtott támogatásával, a TKP2021-EGA pályázati program finanszírozásában valósult meg.
- Kamel EM, Thumshirn M, Truninger K, Schiesser M, Fried M, Padberg B, Schneiter D, Stoeckli SJ, von Schulthess GK, Stumpe KD. Significance of incidental 18F-FDG accumulations in the gastrointestinal tract in PET/CT: correlation with endoscopic and histopathologic results. J Nucl Med. 2004 Nov;45(11):1804-10. PMID: 15534047.
- Hwang JP, Woo SK, Yoon SY, Jeong SY. The potential usefulness of (18)F-FDG PET/CT for detecting colorectal carcinoma and adenoma in asymptomatic adults. Ann Nucl Med. 2015 Feb;29(2):157-63. doi: 10.1007/s12149-014-0922-x. Epub 2014 Oct 31. PMID: 25358843.
3. Transztiretin-típusú szímamiloidózis vizsgálata 99mTc-mal jelölt pirofoszfáttal
Laczkó Katalin1, Czibor Sándor1, Pozsonyi Zoltán2, Magyar Zita3, Varga Zsolt1, Györke Tamás1
1: Semmelweis Egyetem, Orvosi Képalkotó Klinika Nukleáris Medicina Tanszék, Budapest
2: Semmelweis Egyetem, Belgyógyászati és Hematológiai Klinika, Budapest
3: Semmelweis Egyetem, Általános Orvostudományi Kar, Budapest
Bevezetés: A szívet érintő amiloidózis hátterében az esetek döntő többségében a könnyűlánc (AL) vagy a transztiretin (TTR) típusok állnak. Ezek elkülönítése eltérő terápiás igényeik miatt alapvető fontosságú, melyben többek közt az izotópdiagnosztika is kiemelkedő szerepet tölt be.
Módszer: Szívamiloidózis klinikai gyanúja miatt Intézményünkbe utalt betegek esetében 99mTc izotóppal jelzett pirofoszfát intravénás beadása után korai (1 órás) és késői (3 órás) planáris, valamint korai időpontban a mellkas régiójáról SPECT és natív, alacsony dózisú CT (SPECT/CT) felvételeket készítettünk. Szemikvantitatív mérésként a planáris felvételeken a szív és az ellenoldali mellkasfél beütésszámának összehasonlítását végeztük (H/CL-index), vizuális értékelésként a Perugini-gradinget használtuk. A vizsgált betegek hisztopatológiai, laboratóriumi, és képalkotó vizsgálatok alapján kerültek klasszifikációra szívamiloidózis vonatkozásában, pozitív esetben AL és TTR típust is megkülönböztetve.
Eredmények: Mintánkat 41 beteg képezte (31 férfi és 10 nő), átlagéletkoruk 73 év (44-89 év). Közülük 25 betegnél volt megállapítható szívamiloidózis diagnózisa, amelyből 18 TTR és 7 AL amiloidózisnak bizonyult. Vizuális értékelés alapján az igazolt TTR-amiloidózisok esetében néhány kivétellel valamennyi eset Perugini-grade alapján 3-as értékűnek, míg a nem amiloidózisos és AL-amiloidózisos esetekben egy kivétellel valamennyi 0 és 1-es értékűnek bizonyult. A két független obszerver által kalkulált H/CL-index értékek magas korrelációt mutattak egymással (Pearson r(korai)= 0,94, r(késői)= 0,89). A korai és késői felvételeken mért H/CL-index alacsonyabb volt a szívamiloidózisra negatívként klasszifikált (1,06±0,14 és 1,07±0,11) és az AL-amiloidózis (1,12±0,14 és 1,04±0,07) csoportba eső betegekben, mint a TTR amiloidózis (1,5±0,2 és 1,43±0,16) csoportban. A késői felvételeken mért H/CL-index értéke közepes korrelációt mutatott a hátsófali (r= 0,5) és szeptális (r= 0,59) balkamrai falvastagsággal, illetve fordított arányosságot a balkamrai ejekciós frakcióval (r= 0,36). A korai felvételeken mért H/CL-index gyenge korrelációt mutatott a Troponin-T értékével (r=0,36), egyebekben a H/CL index a Troponin-I, a BNP és az NT-ProBNP értékével nem mutatott érdemi korrelációt.
Következtetések: A 99mTc-pirofoszfát szcintigráfia effektív és noninvazív módon segít a szívamiloidózis differenciáldiagnosztikájában. A H/CL-index jól reprodukálható szemikvantitatív paraméter, mely a kórkép klasszifikációján túl a szívelégtelenség különböző paramétereivel is összefüggést mutat.
4. Agyi vascularis rezerv kapacitás megítélése a carotis rendszert érintő szűkületekben
Német Rita, Urbán Szabolcs, Sipka Gábor, Farkas István, Bakos Annamária, Mikó Zsófia, Czékus Tamás, Pávics László, Besenyi Zsuzsanna
Szegedi Tudományegyetem Nukleáris Medicina Intézet, Szeged
BEVEZETÉS: A heveny agyi katasztrófák kiemelt népegészségügyi jelentőségűek, melyek túlnyomó részét ischaemiás kórképek adják, 60-70%-ban extracranialis carotis szűkület a felelős. A stroke megelőzésében nagy jelentőségű azon vasculárisan veszélyeztetett betegek kiemelése, akikben invazív revascularizációs terápiával jó terápiás eredmény várható. Vizsgálatunk célja a nyugalmi és acetazolamid terheléses agyi 99mTc-HMPAO SPECT/CT vizsgálatok kvantitatív értékelése során nyert eredmények összevetése az a. carotis interna (ACI) ereiben kimutatott stenosisok mértékével.
ANYAG ÉS MÓDSZER: A retroprospektív vizsgálatba Intézetünkben készült szignifikáns extracranialis carotis stenosis diagnózisával vizsgált 34 beteg került bevonásra (23 férfi, 11 nő, átlagéletkor 65±11 év). Minden esetben 1 héten belül 99mTc-HMPAO nyugalmi és acetazolamid terheléses agyi perfúziós SPECT/CT vizsgálat készült multipinhole kollimátorral. A CT alapú attenuáció korrigált rekonstruált SPECT metszeti képeket vizuális és kvantitatív módon értékeltük, mely során elemeztük a nyugalmi és terheléses perfúziós viszonyokat, definiáltuk a terhelés hatására megjelenő hypoperfúziót, mely vascularis rezerv kapacitás csökkenést jelentett. Az a. carotis internát érintő szűkületek mértékét CT angiographiás (CTA) vizsgálat alapján felállított stenosis pontrendszer szerint értékeltük. Score 1. <50%, 2. 50-69 %, 3. 70-90 % , 4. >90%, 5. total occlusio.
EREDMÉNYEK: A bevont betegeket két csoportra osztottuk. “A” csoportban 13/34 betegben egyoldali extracraniális-intracraniális (EC-IC) artériás bypass műtét történt. “B” csoportban 21/34 beteg esetén bypass műtéti beavatkozás az anamnézisben nem szerepelt. Az „A” csoportban nyugalmi hypoperfúzió igazolódott 4/13 (5 hemipsherium), irreverzibilis állománykárosodás 8/13 (8 hemispherium), terhelés során felépő csökkent vascularis rezerv kapacitásra utaló hypoperfúzió 2/13 (2 hemispherium) betegben. Ezen betegcsoportban átlag 2,8 CTA pontértéket találtunk, az alábbi eloszlásban score 5: 8 ACI, score 4: 4 ACI, score 3:1 ACI, score 2: 3 ACI, score 1: 10 ACI. A „B” csoportban nyugalmi hypoperfúzió 13/21 (15 hemispherium), irreverzibilis állománykárosodás 8/21 (8 hemispherium), csökkent vascularis. rezerv 8/21 betegben (8 hemispherium) igazolódott. A „B” csoport CTA score értéke átlagát 2,42-nek találtuk, alábbi eloszlás szerint score 5: 14 ACI, score 4: 4 ACI, score 3: 0 ACI, score 2: 5 ACI, score 1:19 ACI. Összehasonlítva a 99mTc-HMPAO SPECT/CT és CTA során kapott eredményeket csökkent vascularis rezev kapacitás az összes beteg (10/34) 29 %-ában mutatkozott: az „A” csoportban ez az arány 15 % (2/13), szemben a B csoportban 38% (8/21).
KÖVETKEZTETÉS: Módszerünk hatékonynak bizonyult mind a beavatkozáson még át nem esett szignifikáns carotis szűkülettel diagnosztizált, mind a már korábbi bypass műtéten átesett követett betegek agyi vascularis rezerv kapacitásának megítélésében. A műtéti beavatkozáson még át nem esett betegcsoport több mint felében, a szignifikáns mértékű carotis stenosis ellenére, cerebrovaszkuláris veszélyeztetettség nem mutatkozott, így elkerülhetővé váltak a nagy kockázatú invazív műtéti beavatkozások. Ugyanakkor az idegsebészeti terápiás terv megválasztásának szempontjából kiemelt jelentőségű a csökkent vascularis rezerv kapacitást mutató magas rizikójú betegek definiálása, az irreverzibilis agyi károsodások megelőzése.
5. A nagy dózisú ablatív radiojód terápia hatékonyságának matematikai módszerekkel történő becslése differenciált pajzsmirigyrákos betegek esetében
Nagy Szanella (1), Sipka Gábor (1), Mikó Zsófia (1), Farkas István (1), Czékus Tamás (1), Német Rita (1), Bakos Annamária (1), Urbán Szabolcs (1), Besenyi Zsuzsanna (1), Valkusz Zsuzsanna (2), Pávics László (1)
(1) Szegedi Tudományegyetem Nukleáris Medicina Intézet
(2) Szegedi Tudományegyetem Belgyógyászati Klinika, Endokrinológiai Munkacsoport
BEVEZETÉS: Hazánkban a pajzsmirigyrák incidenciája növekvő tendenciát mutat, amely megkívánja a betegség terápiás és utánkövetési protokolljának dinamizálását. Intézetünkben 2016 óta végezzük a teljes pajzsmirigyeltávolításon átesett differenciált pajzsmirigyrákos betegek nagy dózisú 131I-radiojód terápiáját. A rutin követés során alkalmazott protokoll szerint a posztterápiás felvételeken túl hat és tizenkét hónappal készül a betegekről nyaki lágyrész ultrahang és jód-egésztest SPECT/CT vizsgálat, a tumormarkerek meghatározása mellett. Vizsgálatunk célja volt, hogy összehasonlítsuk és kapcsolatokat találjunk statisztikai, illetve matematikai módszerekkel a klinikai, szövettani, onkológiai adatok és képalkotó módszerek között a terápia sikerességének becslésére.
MÓDSZEREK: Retrospektív kutatásunkba 58 (13 férfi és 45 nő, 54 éves átlagéletkorral) pajzsmirigy carcinomával diagnosztizált betegünket válogattuk be, akik a teljes pajzsmirigyeltávolítást követően részesültek ablatív radiojód kezelésben. A beválogatásnál további kritérium volt a kezelés előtt elvégzett vérvétel (tumormarkerek, hormonértékek és vérkép ellenőrzése), nyaki ultrahang és jód-egésztest SPECT/CT vizsgálaton való részvétel, melyet a kezelés utáni hatodik és tizenkettedik hónapban megismételtünk. Összesen 56 paraméter kapcsolatát vizsgáltuk statisztikai és nemlineáris matematikai analitikai módszerekkel.
EREDMÉNYEK: 58 beteg közül 47 papillaris, 8 follicularis és 3 Hürthle-sejtes pajzsmirigy carcinoma iránydiagnózissal került intézetünkbe. A papillaris carcinomák esetében szignifikánsan jobb terápiás eredményeket értünk el, mint egyéb pathológiás esetekben (Kí-négyzet próba, p=0,0168). A metastasisok jelenléte (Kí-négyzet próba, p=0,0088), a lymphaticus (p=0,027), perinuclearis terjedés, (p=0,0094) illetve a magas mitotikus aktivitás (p=0,0015) is az ismételt radiojód terápia szükségességével függött össze. Meglepő módon a T, N stádiumok, illetve a resectios szél épsége, szöveti atypia, vénás terjedés és tokáttörés nem mutatott szignifikáns kapcsolatot a terápia sikerességével. Nem lineáris matematikai analitikai módszer segítségével a terápiát követő hatodik hónapig összegyűjtött és felhasznált tulajdonságok alapján a terápia sikerességét 93%-os valószínűséggel tudtuk megközelíteni.
KÖVETKEZTETÉS: Eredményeink alapján megállapítható, hogy a terápia sikeressége akár a hatodik posztterápiás hónapban már kellő biztonsággal, magas valószínűséggel előre jelezhető, mely alapján ismétlő terápia indikációja szinte időveszteség és esetleges tumorprogresszió lehetősége nélkül korán, már a hatodik hónapban elkezdhető. A primer szövettan, lymphaticus és perinuclearis terjedés, illetve a magas mitotikus aktivitás és áttétképzési hajlam pozitív prediktív faktorként mutatkoztak a vizsgálatunkban.
6. A radiosynoviorthesis 37 éve Magyarországon /1985-2022/
Szentesi Margit
Budai Irgalmasrendi Kórház, Semmelweis Egyetem Reumatológiai és Klinikai Immunológiai Tanszék, Budapest
Radiosynoviorthesisről/RSO/ az első közlemény 1952-ben Fellinger (1) tollából jelent meg, a módszer azóta az egész világon elterjedt. Magyarországon 1985 óta végzünk RSO-t. Az első 205. beteg eredményéről, 1991-ben az EULAR-on számoltunk be (2). A betegek 75%-ban értünk el kitűnő és jó eredményt. Azt, hogy a módszer hatásos, bizonyítja, hogy a betegek 75%-át még 10 év múlva sem kellett újra pungálni. Fölmerül a kérdés, hogy a klinikai javulás hátterében milyen arthroscopos és szövettani változások zajlanak. Ennek bizonyítására 1988-ban 20 Rheumatoid Arthritises /RA/ betegnél végeztünk arthroscopos és szövettani vizsgálatot RSO előtt 6 héttel, és eredményes RSO után fél évvel, 1, 2 vagy 3 évvel. Vizsgálatainkkal bebizonyítottuk, hogy a klinikai javulást arthroscopos és szövettani változás is kiséri (3, 4). Vizsgálataink azt mutatták, hogy, az Ozmiumos kémiai synovectomia és az Y-90 RSO által létrehozott szövettani változás alapvetően különbözik (5). Ozmium adása után idegentest óriássejteket, ozmium depozitumokat találunk.
1994-ben, az addig elért eredményeket „ Az Yttrium-90 radiosynoviorthesis eredményessége krónikus térdízületi synovisek kezelésében „ című kandidátusi disszertációban foglaltam össze (6). 1994-ben csak 40 év fölött lehetet RSO-t végezni a CT-nek megfelelő, 20 RAD sugárterhelés miatt. 1993-tól olyan izotópok kifejlesztésén dolgozunk, melynek sugárterhelése kicsi, 2 RAD, gyerekeknek is adható, nincs kromoszóma károsító hatása, hatásosan szünteti a synovitist. Az első eredményekről 2000-ben számoltunk be (7), Az állatkisérleteket 2000-ben (8), és 2001-ben (9) végeztük. Állatkísérleteink bizonyították, hogy a beadott izotóp /166-Holmium-phytát/ a beadás helyén maradt (10). A fázis I-IIA vizsgálatot 2002 máj. 20-tól végeztük (11), mellyel klinikai paraméterek segítségével bizonyítottuk a 166-Holmium hatásosságát (12), UH vizsgálat segítségével igazoltuk, hogy a synovium rétegvastagsága az 555 és 925 MBq 166-Ho adása után szignifikánsan csökken (13). Elfolyási vizsgálatok segítségével bizonyítottuk, hogy a beadott izotóp 99% -a a térdízületben marad, a vérben és vizeletben nem jelenik meg, labor módszerekkel láthatóvá vált, hogy vérkép, máj és vesekárosodást nem okoz. A Fázis III vizsgálatot 2003-2005 között végeztük. (14). Ebben bizonyítást nyert, hogy 600 MBq 166-Ho hatásos, a betegek 94%-ban szünteti meg a térdízületi synovitist (15), nincs kromoszóma károsító hatása (16), a beadott izotóp 99%-a térdízületben marad (17), UH segítségével a synovium rétegvastagságának szignifikáns csökkenését észleltük (18). 2009-ben a 166-Holmium-phytátot törzskönyvezték. 2009-ben elkészült a RSO módszertani levél (19) 2010-ben „ A térdízület radiosynoviorthesis kezelése”-ét befogadó HBCS készült. Összehasonlítottuk az általunk rutinszerűen alkalmazott 2 izotóp 90-Y és 166-Ho elfolyását (20), mellyel megállapítottuk, hogy az eredeti célkitűzésünknek megfelelően olyan izotópot állítottunk elő, melynek sugárterhelése kicsi, 2 RAD, gyerekeknek is adható, nincs kromoszóma károsító hatása, hatásosan szünteti a térdízületi synovitist és közép nagy ízületek kezelésére is alkalmas.
A 2000-es években a biológiai kezelés bevezetésével a gyulladásos betegek /RA, SPA, Arthritis psoriatica, SNSA/ életminősége alapvetően megváltozott. 82 biológiai kezelésben részesülő RA-es, RSO-en átesett beteg adatainak feldolgozásával bizonyítottuk, hogy a RSO-nek a biológiai kezelés mellett recidiváló 1-1- ízület synovitisének kezelésében van létjogosultsága, ha a RSO megszünteti a synovitist, nincs szükség báziskezelés, biológiai kezelés váltására, sebészeti műtétre (21). A korábban remisszióban lévő beteg, hatásos RSO után ismét remisszióba kerül.
2019-ben 141 inflammált osteoarthritises beteg 10 éves nyomonkövetéses adatainak feldolgozásával bizonyítottuk, hogy ha a térdben gyulladás van, a synovitis megszüntetésével lassíthatjuk a progressziót (22). 2020-ban a RSO előtt műtéten átesett betegek adatainak feldolgozásával bizonyítottuk, hogy ha a synovitist fenntartó tényező megoperálása után is perzisztál a synovitis, érdemes RSO-t végezni, mert ugyanolyan eredményes, mintha nem történt volna műtét (23).
A munkát mindenféle pályázati támogatás nélkül végeztük. A munka Budai Irgalmasrendi Kórház, a Semmelweis Egyetem, Az Országos Hematológiai Intézet, László Kórház, Izotóp Intézet Kft, Országos Sugárbiológiai és Sugáregészségügyi Intézet, Sport Kórház, mintegy 50 diplomás, 15 tudományos fokozattal rendelkező, számos asszisztens, nővér együttműködésének eredményeként jött létre. A munkában reumatológusok, izotóp szakorvosok, radiológusok, ultrahangos szakemberek, ortopédek, artroszkópos szakemberek, hematológusok, patológusok, anatómusok, állatorvosok, gyógyszerészek, sugárbiológusok, vegyészek vettek részt.
2022. május 20. péntek, 14:00 – 15:30, Asszisztens előadások
1. Fokozott barnazsírszöveti aktivitás előfordulási gyakorisága FDG PET/CT vizsgálatok során
Kisiván Tímea1, Fajtai Dániel1, Takács Alíz1, Tóth Zoltán1
1Medicopus Nonprofit Kft., Kaposvár
Bevezetés: A barnazsírszövet (BAT) egy olyan termogén szövet, amely fontos szerepet játszik a rágcsálók és az újszülöttek hőszabályozásában. Jelenlétét felnőtt emberek esetén FDG PET/CT vizsgálattal igazolták. Leggyakrabban a rekesz feletti nyirokrégiókban és a vesék környezetében ábrázolódik, az FDG PET vizsgálatok értékelését nehezítheti. Vizsgálatunk célja a fokozott barnazsírszöveti aktivitás előfordulási gyakoriságának felmérése teljestest FDG PET/CT vizsgálatok során, a kaposvári központ beteganyagán, valamint a BAT előfordulását befolyásoló tényezők értékelése.
Módszer: Retrospektív felmérésünkben, a központunkban 2014 és 2018 között teljestest FDG PET/CT vizsgálaton átesett páciensek adatait dolgoztuk fel. A betegadminisztrációs rendszerből kigyűjtöttük azon betegek adatait, akiknek a leletében szerepelt fokozott barnazsírszöveti aktivitás. Az előfordulási gyakoriságot a páciensek neme, testtömeg indexe (BMI), életkora, illetve a vizsgálat időpontjához tartozó évszak függvényében külön is értékeltük. A statisztikai analízishez Tukey-féle tartománytesztet, varianciaanalízist (ANOVA), és Shapiro-Wilk tesztet alkalmaztunk, R-szoftver (3.3.0.) és Microsoft Office Excel (2010) használatával.
Eredmények: 9138 teljestest FDG PET/CT vizsgálat közül 373 esetben (4.08%) ábrázolódott fokozott barnazsírszöveti aktivitás. Női pácienseknél (nők: 6.64 %, férfiak: 1.27%,), fiatalabb életkorban (50 év alattiak: 16.3%, 50-60 év között: 3.8%, 60-70 év között: 1.2%, 70 év fölött: 0.5%), alacsonyabb BMI esetén (alultáplált csoport: 6.71%, normál súlyúak: 6.99%, túlsúlyosak: 2.99%, elhízottak: 1.41%), valamint hidegebb évszakokban végzett vizsgálatok során (ősz: 4.46%, tél: 5.56%, tavasz: 3.65%, nyár: 2.49%) egyaránt gyakrabban megfigyelhető volt aktivált barnazsírszövet. 27 olyan páciensnél, akinél metabolikusan aktív BAT ábrázolódott, a kontroll vizsgálatuk során béta-blokkoló premedikációt alkalmaztunk. Az ismételt felvételeken 14 esetben (51.8%) nem ábrázolódott, 13 esetben (48.2%) csak alacsonyabb intenzitású barnazsírszöveti aktivitás volt észlelhető.
Következtetés: A kaposvári betegcsoportban az irodalmi adatokhoz hasonló gyakorisággal fordult elő fokozott barnazsírszöveti aktivitás, nők esetében, fiatal életkorban, alacsony BMI, illetve hidegebb évszakokban végzett vizsgálatok során a feldolgozott beteganyagban is gyakrabban volt látható. Kis dózisú bétablokkoló alkalmazásával aktivitása mérsékelhető.
2. Liquorcsorgás vizsgálatok a Semmelweis Egyetemen asszisztensi szempontból – csapatmunka nélkül nem megy
Scheidl Ágota1, Képes Andrea¹, Tóthné Török Krisztina¹, Gráf Mihályné¹, Nagy Julianna¹, Leskó-Jancsó Vivien¹, Kovácsné Tóth Szilvia¹, Apostol Judit¹, Süket Anikó Erika¹, Klenota Alexandra¹, Kristóf Emese¹, Jánosa Cintia¹, Kiss Fanni Júlia¹, Laczkó Katalin¹, Varga Zsolt¹, Milecz-Mitykó Richárd¹, Kári Béla1,2, Ilniczky Sándor³, Györke Tamás¹
1Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
2Semmelweis Egyetem, Orvosi Képalkotó Klinika, Radiológia Tanszék, Budapest
3Semmelweis Egyetem, Neurológiai Klinika, Budapest
Bevezetés: A liquorcsorgás kimutatása és helyének meghatározása fontos diagnosztikai feladat. Azon a kapun, ahol a subarachnoidális térből liquor lép ki, az extracraniális térből fertőzés hatolhat be, sok esetben következmény lehet a meningitis, valamint liquorhypotensio kialakulása. A jól felállított diagnózis lehetővé teszi a műtéti megoldás sikerességét, ami kontroll vizsgálattal igazolható is.
Módszerek: A radiofarmakon (99mTc-DTPA) intrathecalis beadása után 20 percig anterior és posterior irányú dinamikus felvételsorozat készül a koponyáról és a cervico-thoracalis régióról, majd ugyanezen régióról 1, 4 és 24 óra múlva anterior, posterior és oldalirányú planáris, 4 (és sz.e. 24) óra után SPECT- és alacsony dózisú CT felvételek készülnek. Nasalis csorgásnál az orrba felhelyezett tamponok és a vér radioaktivitását (háttéraktivitást) mérjük üreges mérőhelyben.
Eredmények: Az elmúlt két évben a Semmelweis Egyetem Nukleáris Medicina Tanszéken összesen 18 vizsgálatot végeztünk liquorcsorgás kimutatásának az indikációjával. 9 esetben a liquorkilépésre utaló jel nem volt detektálható. 9 esetben liquorcsorgást tudtunk igazolni, 3 esetben a kilépés helye is kimutatható volt, 1 esetben sejthető. Az utóbbi 9 esetből 1 kisgyermeknél altatásban végeztük a vizsgálatot. Minden esetben, amikor liquorcsorgást igazoltunk, akkor a vatták mérési eredménye is igazolta azt.
Következtetés: Asszisztensi szempontból fontos a betegek vizsgálatának körültekintő szervezése, az egyeztetés a Neurológiai Klinikával a lumbálpunkció szakszerű kivitelezése és a beteg 24 órás obszerválása miatt. Gyakorlott, megtervezett asszisztensi munka szükséges a lumbálpunkció, ill. az intrathecalis beadás során felmerülő feladatok ellátásához. Elengedhetetlen továbbá a csorgás helyéről gyűjtött váladék (tampon) és a 4 órás vérsavó beütésszámának pontos és reprodukálható lemérése, ill. a szükséges adatok megbízható rögzítése.
3. Tüdőtumorok ablációját követő 24 órán belül végzett PET/CT vizsgálatok a Semmelweis Egyetemen
Albert Orsolya1, Futácsi Balázs2, Bánsághi Zoltán2, Takács Imre2, Kiss Fanni Júlia1, Czibor Sándor1, Kiss Eszter1, Szoó Anett1, Balogh Anna1, Gál Magdolna2, Scheidl Ágota1, Györke Tamás1
1: Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
2: Semmelweis Egyetem, Orvosi Képalkotó Klinika, Radiológia Tanszék, Budapest
Bevezetés: A rádiófrekvenciás (RF), illetve a mikrohullámú (MW) abláció a primer tüdőtumorok és a pulmonalis metastasisok lokális terápiás palettájának része, amelyet hazánkban egyedülálló módon végzünk rutinszerűen a Semmelweis Egyetem Orvosi Képalkotó Klinikáján. Ezen eljárások olyan betegeknél alkalmazhatók, akiknél sebészi ellátás (vagy sugárterápia), különböző komorbiditások, vagy épp betegdöntés miatt nem jön szóba. A kezelések lényege, hogy egy tomográfiás képalkotó vizsgálat segítségével meghatározott célterületre egy tűelektródát juttatunk, majd elektromos áram vagy mikrohullámú sugárzás segítségével a tű körül lokális hőhatást hozunk létre. Ezen lokális hőhatás denaturálja a tumort és vele együtt egy 5-10 mm-es ép biztonsági zónát, de a környező ép szöveteket egyébként érdemben nem károsítja.
Nemcsak maguk az eljárások, hanem a betegek utánkövetése is egyedi hazai szinten, ugyanis intézetünkben ez egy, a terápiát követő, 24 órán belül elvégzett posztablációs FDG-PET/CT vizsgálatot is magába foglal.
Módszerek: A betegek kiválasztását követően az intervencióban is részt vevő PET/CT operátori feladatok közé tartozik a betegtájékoztatás, a vizsgálathoz szükséges laborparaméterek ellenőrzése, az ablációban való asszisztencia, a kontroll vizsgálatok megszervezése és elvégzése, a szövődmények észlelése és jelentése, a betegekkel, illetve a kezelőorvossal (intervenciós radiológus, pulmonológus) való kapcsolattartás. Mivel az egész folyamat multidiszciplinaritást igényel, ezért a betegút valójában igen bonyolult. Az abláció elvégzése előtt figyelembe kell venni a betegek anamnézisét, a régebbi és a közelmúltban kapott kezeléseit, illetve gyógyszerelését, hiszen ezek mind befolyásolhatják a PET/CT érzékenységét. Mivel az ablációt követően a pulmonológián obszerválják a betegeket, a 24 órás időkorlát miatt fontos a jó kommunikáció a kezelőorvossal és a betegszállítókkal, hogy a beteg időben érkezzen, éhomi állapotban, szteroid adása nélkül. A beavatkozást követő napon a reggeli órákban a mellkasi régióról natív, alacsony dózisú CT- és PET-leképezést végzünk, szövődmények észlelése esetén pedig egy belégzésben készült, diagnosztikus, natív mellkas CT-felvétellel egészítjük ki a vizsgálatot.
Eredmények: A tüdőtumoros betegek baseline diagnosztikájának szerves része a PET/CT, ezt követően a különböző terápiák kontrolljára általában hetek vagy hónapok után kerül sor. A klinikánkon rutinszerűen elvégzett 24 órán belüli posztablációs PET/CT előnye, hogy ekkor még nem kell számolni a kezelést követően kialakuló és hetekig fennálló reaktív gyulladással, így gyakorlatilag azonnal, igen magas megbízhatósággal megítélhető az abláció eredményessége. Inkomplett kezelési eredmény esetén gyorsan tervezhető további kiegészítő terápia. A 24 órán belüli PET/CT során az esetlegesen fellépő szövődményeket is korán észlelhetjük (pneumothorax, vérzés), amelyeket rögtön jelezni tudunk a kezelőorvosnak.
Következtetés: A betegek biztonságos és professzionális ellátása mellett előnyt jelent az, hogy az ablációt követően már másnap korai választ adunk egy beavatkozás eredményességéről, és ha szükséges hozzásegíthetjük a betegeket a minél korábban megkezdett további adekvát terápiához. A 24 órán belül elvégzett posztablációs PET/CT-vizsgálatot magas költsége és a multidiszciplinaritásból adódó szervezési nehézségei miatt egyelőre csak klinikai kutatás keretein belül alkalmazzuk.
4. Tücsök és bogár – avagy a nukleáris medicina érdekességei
Dombai Emília, Görgeiné Vass Andrea, Némethné Szabolcsi Erika, Száraz Adrienn
Pécsi Tudományegyetem JPKT OKK Nukleáris Medicina Tanszék
Célunk az elmúlt időszak nehéz járványügyi helyzetén túllendülve egy kis mosolyt csalni kollégáink arcára.
Módszer: Az izotóp diagnosztikai vizsgálatok bemutatása az asszisztensek szemszögéből, amikor a fantázia és a humor kerül előtérbe.
Eredmények: A sok év alatt elvégzett vizsgálatból kiragadott képanyagból és beutalókból összeállított gyűjteményünket mutatjuk be. Például: Milyen is lehet egy 99m-Tc MIBI szív vizsgálat, amikor az ördög a betegben lakozik? Vagy, amikor húsvéti meglepetést láttunk egy 99m-Tc pajzsmirigy vizsgálatnál! Szeretnénk a mi kis állatgyűjteményünket is megmutatni Önöknek, ezenkívül számos érdekes és vicces képpel is találkozhatnak.
Következtetés: Reméljük poszterünk elérte célját, és ezután mindenki kicsit más szemmel tekint a vizsgálatok alatt véletlenül felfedezett érdekes alakzatokra.
5. A BMI hatása az FDG-vel vizsgált betegek dózisteljesítményére
Pongrácz Barbara1, Kovács Réka1, Kökény Krisztina1, Reinprecht Bernadett1, Szőcs Annamária1, Tóthné Bődi Mária1, Moravszki Mónika1, Buga Klára1
1Magyar Honvédség Egészségügyi Központ Nukleáris Medicina Osztály, Budapest
Bevezetés: A dózisteljesítmény monitorozása alapvető, hiszen megadja a pillanatnyi sugárterhelés mértékét és fontos tudni, hogy távozáskor a beteg vizsgálata után mennyire terheli környezetét. Ahhoz, hogy a radiofarmakonnal injektált beteget a környezetbe kiengedjük, tudnunk kell ennek a megközelítő értékét.
Anyag és módszer: A dózisteljesítmény mérése minden esetben a PET/CT scan (vizsgálat kezdete az injektálást követő 60±7 perc) után 20 perccel és vizeletürítés után történt 1 méter távolságból. A méréshez egy Berthold LB-6360-H10 fali detektor rendszert használtunk, ami egy proporcionális detektorral méri a dózisteljesítményt, a jelzési szint 25 µSv/h-ra (microSievert/óra) van beállítva. Intézetünkben az FDG-vel (18F-fluorodeoxiglükóz) vizsgált betegeknek injektált aktivitásmennyiségét a BMI (body mass index/testtömeg index) segítségével határozzuk meg. Feldolgozásra került eddig 150 beteg anyaga a beadott aktivitás és a dózisteljesítmény tekintetében. Két csoportra osztjuk a testtömeg index alapján a beadandó aktivitás mennyiségét: 30 BMI alatt 2,5 MBq, 30 BMI felett 3 MBq FDG kerül kiosztásra testsúly/kilogrammonként.
Eredmény: Azt megállapíthatjuk, hogy a mérések már egy felezési idő (109,7 perc) leteltével készültek. Átlagot számolva mindkét BMI csoportnál a következő eredményeket kaptuk: 30 BMI alatt a beadott FDG mennyisége átlagosan 173 MBq, ehhez 11 µSv/h dózisteljesítmény társult mérésünk időpontjában. 30 BMI felett az aktivitás mennyiség átlagosan 282 MBq, valamint 16 µSv/h a dózisteljesítmény.
Következtetés: Tehát nálunk is igazolódott, hogy minél nagyobb a beadott FDG aktivitás mennyisége, annál nagyobb lesz a mért dózisteljesítmény is. Ez a betegszervezés szempontjából kifejezetten hasznos, hiszen a nagyobb BMI-vel rendelkező betegek esetében meg tudjuk becsülni, hogy mennyivel több várakozási idővel kell számolnunk, illetve evéssel, ivással elő tudjuk segíteni a környezeti sugárterhelésük csökkentését. Az osztályon elhelyezett sugárkapu nem csak a lakosság, hanem a személyzet sugárterhelését is jelentősen csökkenti, hiszen így elkerülhető a már megvizsgált betegek inaktív területen történő megjelenése.
6. Légzés kapuzott FDG PET/CT vizsgálat tapasztalatai
Horváth Dorina, Balog László, Visnyei Lilla, Horváth Gáborné, Szvetanay Monika, Sipka Gábor
SZTE Nukleáris Medicina Intézet
BEVEZETÉS: Az FDG-PET/CT alkalmazása az elmúlt évtizedben széles körben elterjedt diagnosztikai eszközzé vált az onkológiában. A funckionális képalkotó módszer szerepe rendkívüli jelentőséggel bír számos daganattipus definitív besugárzástervezésében is. Vizsgálatunk célja a technológusi feladatok összefoglalása a légzéskapuzott FDG-PET/CT vizsgálat kivitelezése során.
ANYAG ÉS MÓDSZER: 2021 júliusa óta az SZTE Nukleáris Medicina Intézetében bevezetésre került a légzés kapuzott PET leképezés FDG vizsgálatokban. Kétféle légzés-kapuzott vizsgálatot végzünk (Q-freeze, Q-static). A Q-freeze módszer során a CT- és PET-adatok a légzési ciklus minden egyes fázisában begyűjtésre kerülnek, a beteg mellkasa fölé helyezett detektor segítségével, majd egyetlen képként kerülnek megjelenítésre. A Q-static során a normál légzési ciklus kilégzési-végi nyugalmi periódusaiban készül PET leképezés, melynek köszönhetően válnak a mozgási műtermékek kiküszöbölhetővé. Orvosaink által Q-freeze-indikált vizsgálatokat: nyelőcső, tüdő, mediastinalis daganatok besugárzástervezése, Q-static-indikált leképezést: különböző, a kérőlap alapján ismert tüdődaganatok, tüdőmetasztázisok, mediastinalis térfoglaló folyamatok, lymphomák, rekesz közeli májáttétek jelenlétekor végzünk. Besugárzástervezéshez a betegek standardizált fektetését, szükség szerint 6 pontos, termoplasztikus maszkrögzítéssel történő pozicionálást magunk végeztük az Onkoterápiás Klinikával együttműködésben.
EREDMÉNYEK: 2021-től kezdődően 25 Q-freeze, 329 Q-static leképezést végeztünk. A Q-freeze általi légzéskapuzott besugárzás tervezéshez elsőként CT fantom vizsgálatot végeztünk, melyen a tervezés lépéseit szimuláltuk az onkoterápiás klinika fizikusaival és technológusaival együttműködésben. A betegvizsgálatok során a sugárkezelés végleges céltérfogatát intézetünk és a sugárterápiás szakorvosok konszenzusa alapján határozzák meg. A betegek sugárkezelése ezt követően standardizált fektetésben légzés kapuzott, képvezérelt, intenzitásmodulált technika alkalmazásával az onkoterápiás klinikán történik. A Q-static módszer használatával a légzési műtermékek elkerülése miatt pontosabb kvantitatív és morfológiai információkhoz jutottak orvosaink, a normál légzés mellett készült elnyelés korrigált felvételekhez képest.
KÖVETKEZTETÉS: A társszakmák szoros együttműködésével, a szakemberek közös betanulásával a légzés kapuzott FDG-PET/CT vizsgálat alkalmazása valamelyest növeli ugyan a leképezés idejét, de mással nem pótolható többletinformációt nyújt a tüdődaganatok pontosabb besugárzásának előkészítésében, illetve a légzési műtermékek okozta diagnosztikai nehézségek kiküszöbölésében, mely pontosabb céltérfogat lokalizálást, besugárzást és hatékonyabb daganatterápiát tesz lehetővé.
7. Tapasztalataink EKG kapuzott cardialis FDG PET/CT vizsgálatokkal
Balog László, Horváth Gáborné, Szvetenay Monika, Horváth Dorina, Besenyi Zsuzsanna
SZTE – ÁOK Nukleáris Medicina Intézet, Szeged
BEVEZETÉS: Az onkológiai alkalmazása mellett egyre növekvő számú evidencia áll rendelkezésre az FDG-PET/CT hasznosságáról a különböző etiológiájú szívet érintő gyulladásos kórképben. Tekintettel a fiziológiásan magas myocardialis glükóz-anyagcserére, az infektív és egyéb gyulladásos cardialis betegségek kórisméje speciális beteg-előkészítés nélkül komoly kihívást jelentene. A módszer érzékenysége és a vizsgálat kiértékelése az EKG kapuzott adatgyűjtés révén tovább növelhető.
ANYAG ÉS MÓDSZER: 2021. július óta 12 betegnél végeztünk FDG-PET/CT vizsgálatot, akiknél szívet érintő gyulladásos betegség miatt végeztük a vizsgálatot sarcoidosis, intracardialis eszköz (ICD, pacemaker) körüli gyulladás, műbillenytyű endocarditis gyanúja miatt. A betegeket a vizsgálatot megelőző 48 órás alacsony szénhidráttartalmú, magas zsír és protein tartalmú diéta és 4-12 órás éhezést követően vizsgáltuk. A diétás előkészítést opcionálisan az FDG beadása előtt 15 perccel adott 50 NE/ttkg nem frakcionált heparin adásával egészítettük ki. Három MBq/ttkg FDG intravénás beadását követően 60-90 perccel rutin egésztest, (sarcoidosis gyanúja esetén melanoma protokoll szerinti teljes egésztest) PET/CT leképezés történt, majd a szív-mellkas régiójáról (általában 2 FOV) EKG kapuzott PET adatgyűjtést végeztünk.
EREDMÉNYEK: A vizsgált 12 beteg közül mindössze 2 esetében volt ellenjavallata az intravénás heparin adásának. Mellékhatást egy esetben sem észleltünk. Az EKG elektródák felhelyezése és a kapuzás érdemben nem növelte meg a vizsgálati időt. A kapuzott adatgyűjtést megnehezítő arritmiát nem regisztráltunk. A diétás előkészítésnek megfelelően a fiziológiás myocardialis FDG felvétel minden esetben megfelelő mértékben szupprimált volt, a patológiás folyamatok jó kontraszttal elkülönültek. A kapuzott sorozatok pedig több esetben segítséget nyújtottak orvosainknak a kis kiterjedésű kóros intracardialis folyamatok megítélésénél, valamint az elektródák környezetében látható kóros folyamatok pontos megítélésről.
KONKLÚZIÓ: Az alkalmazott beteg-előkészítés (diétás megszorítások, i.v. nem-frakcinált heparin) minden esetben megfelelően szupprimálták a myocardium FDG-felvételét. Az EKG-kapuzott felvételek minimálisan megnövelték ugyan a vizsgálat idejét, de mással nem pótolható többletinformációt szolgáltattak a myocardium megbetegedéséről, különös tekintettel a szívvel együtt mozgó elektródák, műbillentyűk körüli folyamatokról.
8. Prosztatadaganatok 99mTc-PSMA-SPECT/ CT alapú individuális sugárkezelésének kivitelezése a technológus szemével
Visnyei Lilla, Horváth Gáborné, Szvetenay Monika, Horváth Dorina, Balog László, Farkas István
SZTE – ÁOK Nukleáris Medicina Intézet, Szeged
BEVEZETÉS: A PSMA alapú leképezés a legkorszerűbb diagnosztikai módszer a prosztatadaganatok pontosabb stádium meghatározásában és szerepe ígéretes a definitív besugárzás tervezésében. Vizsgálatunk célja a technológusi feladatok összefoglalása a prosztata daganatos betegek definitív sugárkezelés tervezéséhez fúzionáltan felhasznált 99mTc-PSMA-SPECT/CT vizsgálatok tükrében.
ANYAG ÉS MÓDSZER: 2018-ban az SZTE Nukleáris Medicina Intézetében az SZTE Onkoterápiás Klinikával szoros együttműködésben bevezetésre került a 99mTc-PSMA-SPECT/CT felhasználása a prosztatadaganatos betegek besugárzástervezésében. A betegek standardizált fektetése, lábtartók optimalizálása, a hógyagtelítettség protokoll alkalmazása, a topometriáls CT individuális, 6 pontos, termoplasztikus maszkrögzítéssel történő fektetése az onkoterápiás Klinikán került kidolgozásra. Ezt követően a SPECT/CT vizsgálat során intézetünkben technológusi feladat volt a megfelelő fektetési módszer újrapozícionálása. A műveletsort az onkoterápiás klinika technológusaival közösen végeztük.
EREDMÉNYEK: 99mTc-PSMA-SPECT/CT vizsgálat 28 primer prosztatarákos betegnél történt a besugázás tervezése előtt, melyből 15 beteg volt alkalmas defintív sugárkezelésre. A standard betegpozícináláshoz felhasznált eszközök alkalmazása érdemben nem növelte meg a vizsgálati időt. Az izotópos vizsgálat értékelése, valamint a SPECT/CT információk alapján történő makroszkópos tumorkontúrozás az SZTE Nukleáris Medicina Intézetben kihelyezett kontúrozó állomáson történt nukleáris medicina szakorvos által. A fúzionált képek felhasználása a besugárzás tervezésben 11 betegnél volt kivitelezhető a tanulás fázist követően. A sugárkezelés végleges céltérfogatát intézetünk és a sugárterápiás szakorvosok konszenzusa alapján határozták meg. A betegek sugárkezelése ezt követően standardizált fektetésben képvezérelt, intezitásmodulált technika alkalmazásával az onkoterápiás klinikán történt.
KÖVETKEZTETÉS: A társszakmák szoros együttműködésével a személyzet közös betanításával és a fektetés standardizálásval a 99mTc-PSMA-SPECT/CT alkalmazása csak minimálisan nönöveli az asszisztensi terhelést a prosztatarákos betegek besugárzásnak előkészítésében, de a célterület pontosabb meghatározása révén hatékonyabb kezelést tesz lehetővé.
2022. május 20. péntek, 15:30 – 17:30, Esetismertetések
1. Szív sarcoidosis és primer tüdőtumor diagnosztikája FDG-PET/CT-vel
Sághy László1, Pálfi Máté1 , Benák Attila1, Makai Attila1, Pap Róbert1, Vámos Máté1, Miklós Márton1, Bencsik Gábor1, Németh Tibor2, Furák József2, Zombori Tamás3, Iványi Béla3, Besenyi Zsuzsanna4
1: SZTE Klinikai Központ Belgyógyászati Klinika
2: SZTE Klinikai Központ Sebészeti Klinika
3: SZTE Klinikai Központ Patológiai Intézet
4: SZTE Klinikai Központ Nukleáris Medicina Intézet
Egy 67 éves, syncope és II. fokú AV blokk miatt DDD pacemaker implantation átesett nőbeteg időszakos kontrollvizsgálatán a pacemaker memóriában több nem tartós, és 2 alkalommal kb. 2 percig tartó lassú kamrai tachycardia volt látható, ezért osztályos felvételre került sor katéterabláció (RF) elvégzése céljából. A jobb kamra infero-septalis, basalis területén RF ablatio történt. A beavatkozás során használt 3D elektroanatómiai térképezés során látott kép és a korábban észlelt jobb tüdőfélben mellkasröntgenen felismert, majd mellkas CT-n is igazolt 13x8x8 mm nagyságú spiculált kontúrú képlet alapján felmerült infiltratív betegség, sarcoidosis gyanúja. Szív MRI vizsgálatra került sor, melyen közepes fokban csökkent bal kamrai ejekciós frakció mellett, kórjelző késői típusú kontraszthalmozás alakult ki a basalis és középső harmadban infero- és anteroseptalisan, subepi-midmyocardialis elhelyezkedéssel. Következő stratégiai lépésként PET-CT készült, melyen metabolikusan aktív léziók igazolódtak a myocardiumban, tüdőben, mediastinalisan, valamint a lépben. Korábban mediastinalis thoracoscopia kapcsán nyert nyirokcsomó biopsia azonban negatívnak bizonyult malignitás és sarcoidosis irányában is, ezért video-asszisztált thoracoscopia révén tüdő ékresectio történt, melyből szövettan alapján primer tüdő eredetű invasiv papillaris adenocarcinoma került diagnózisra. A CMR és PET-CT felvételeken látott cardialis laesiok miatt azonban felmerült két betegség szimultán fennállása, ezért szívizom biopszás minta vételét tűztük ki célul. A szövettani vizsgálat a myocardiumban el nem sajtosodó, epitheloidsejtes granulomatosus gyulladást állapított meg, mely cardiális sarcoidózisnak megfelelt. Mindezek alapján a korábban beültetett pacemaker implantálható cardioverter defibrillátorra történő cseréje is elvégzésre került.
2. Nesidioblastosis fokális formájának igazolása DOPA PET/CT vizsgálattal
Kisiván Tímea1, Farkas Dávid1, Kis Luca1, Tóth Zoltán1
1Medicopus Nonprofit Kft., Kaposvár
A congenitalis hyperinsulinismus (CHI, nesidioblastosis) az újszülötteknél jelentkező tartósan visszatérő hypoglicaemia leggyakoribb oka. Közép-Európában 40 000-ből 1 újszülött érintett a betegségben, melyet a hasnyálmirigy autonóm inzulintermelő sejtcsoportjai okoznak. Diffúz és fokális formája különíthető el. A tartós hypoglicaemia súlyos idegrendszeri fejlődési problémákhoz vezethet, ezért fontos a betegség mielőbbi felismerése és kezelése. Amennyiben fokális megjelenési formája azonosítható, az érintett terület eltávolításával gyógyítható. A betegség diffúz és fokális formájának elkülönítése konvencionális képalkotó módszerekkel általában nem lehetséges, azonban a DOPA PET vizsgálat alkalmas lehet rá.
Esetismertetésünkben egy 8 hetes congenitalis hyperinsulinismus miatt kezelt csecsemő DOPA PET/CT vizsgálatáról szeretnénk beszámolni.
Sz. L. A. II/2 terhességből 38. terhességi hétre 3610 g súllyal, Apgar 9/10 állapotban született császármetszéssel. Terhességi diabetes nem állt fenn, a korai adaptációja rendben zajlott. 12 órás korában leszürküléssel járó, majd per os nem rendezhető hypoglicaemiája miatt PIC Osztályon kezelték, ápolása alatt mindvégig magas glucose flow-t igényelt. Hasi-koponya- és kardiológiai ultrahang vizsgálat kórosat nem mutatott, de tünetei nesidioblastoma lehetőségét vetették fel. Diazoxid kezelést indítottak, de emellett sem tudták a páciens parenterális cukorigényét érdemben mérsékelni, ezért a Diazoxid kezelés leállítása után Sandostatin therápiát kezdtek. A nemzetközi kivizsgálási protokoll alapján a Diazoxid rezisztens betegségre tekintettel a kezelőorvos DOPA PET/CT vizsgálatot kezdeményezett CHI fokális és diffúz formájának elkülönítésére.
A páciens vizsgálatát egyedi méltányossági engedély alapján NEAK finanszírozott formában a Somogy Megyei Kaposi Mór Oktató Kórház-Medicopus Kft. PET Centrumában 2021.10.29-én végeztük el. A csecsemő intézetünkbe történő szállítását, valamint az aneszteziológiai hátteret a Szent Márton Gyermekmentő Szolgálat biztosította.
A PET/CT vizsgálatot Siemens Biograph Truepoint 64 kamerával végeztük. 39 MBq F18-DOPA intravénás injektálása után 10- illetve 45 perccel natív low-dose CT (80 kV, 30mAs, +CareDose) valamint 3D fotonemissziós PET adatgyűjtés történt a mellkasbemenettől a symphysisig, ágypozíciónként 2 perces gyűjtési idővel, altatásban.
A hasnyálmirigy test-farok átmenetnek megfelelően a pancreas fiziológiás DOPA felvételét körülírtan-jelentősen meghaladó, gócos radiofarmakon halmozás ábrázolódott a korai és késői PET/CT képeken egyaránt, mely az alapbetegség fokális formájára utalt. Mellékleletként kétoldali tüdőgyulladás került leírásra. Egy héttel a PET/CT vizsgálatot követően a csecsemőt megoperálták, az érintett hasnyálmirigy részlet beazonosítható volt és eltávolításra került. A műtétet követően a csecsemő vércukorszintje normalizálódott, parenterális cukorpótlásra, további Diazoxid vagy Sandostatin kezelésre nem szorult.
A bemutatott eset megerősíti, hogy a DOPA PET/CT vizsgálat alkalmas lehet a CHI fokális és diffúz formájának elkülönítésére, a műtéttel gyógyítható páciensek kiválasztására.
3. A melanómához kapcsolódó sentinel nyirokcsomó-szcintigráfia időzítésének jelentősége
Papp Zsombor Mátyás1, Dabasi Gabriella 1, Vaszilkó Éva 1, Kiss Fanni Júlia 1, Kristóf Emese 1, Györke Tamás 1
1 Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
Bevezetés (Background): A melanoma malignum kezelésében fontos szerepe van a sentinel nyirokcsomó (SLN) szcintigráfiának, hiszen a tumorrégió nyirokelvezetésébe eső első nyirokcsomó kimutatásával az egyébként klinikailag és radiológiailag áttétmentes betegség mikroszkópos áttéte állapítható meg.
A szakmai ajánlások alapján a primer melanoma excízió után, a reoperációval egyidőben szükséges az SLN keresése a legjobb eredmény elérése érdekében. Jelen esetbemutatásban ennek az ajánlásnak a fontosságát támasztjuk alá.
Esetismertetés (Case): 50 éves férfi beteg az 5 mm-es biztonsági szegéllyel a nyak jobb posterior felszínéről eltávolított melanoma malignum műtéte után érkezett tanszékünkre a Bőrgyógyászati Klinikáról 2021.11.15-én SLN szcintigráfia elvégzésére.
Tanszékünkön az ajánlásoknak megfelelően, az első műtét után történt meg a szcintigráfiás vizsgálat 80 MBq 99m Tc- Sentiscint radiofarmakonnal. A műtéti hegvonal köré négy depóban történő intracutan radiofarmakon beadás után 1-2 órával anterior és lateralis irányból planáris felvételeket készítettünk a beteg nyaki és axillaris nyirokcsomó régióiról.
A jelölés sikeres volt, azonban másnap a sebész nem tudta detektálni a radioaktivitást, ezért SLN kimetszés nem történt, a reoperációt viszont 2 cm-es ép széllel elvégezték. 2022.01.10-én második alkalommal is elvégeztük a szcintigráfiás jelölést.
Az első vizsgálatkor csak a jobb axillaris régióban volt detektálható egy SLN-nek megfelelő dúsítási többlet. A második vizsgálat során már a jobb és a bal axilla területén, a bal clavicula környékén, valamint a nyakon is több körülírt radiofarmakon halmozás ábrázolódott.
Következtetés (Conclusion): Úgy véljük, a második jelölés során azért jutott el a radiofarmakon több nyirokrégióba is, mert ekkor már a két műtét következtében, a beadási helyek a bőrkimetszések miatt távolabb estek egymástól, valamint az eredeti elváltozástól, melynek nyirokelvezetését, sentinel nyirokcsomóját szerettük volna vizsgálni.
Ez az eset rámutat annak fontosságára, hogy az egyes diagnosztikai és terápiás lépések megfelelő sorrendben kövessék egymást.
4. Tüdődaganat mikrohullámú ablációjának tervezése és 24 órán belüli 18F-FDG PET/CT kontrollja – esetismertetés
Kelemen Nándor Richárd1, Bánsághi Zoltán2 Futácsi Balázs2, Varga Zsolt1, Czibor Sándor1, Barra Magdolna1, Takács Imre2, Kiss Fanni Júlia1, Albert Orsolya1, Nagy Péter4, Forika Gertrúd4, Bohács Anikó3, Györke Tamás1
1Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék, Budapest
2Semmelweis Egyetem, Orvosi Képalkotó Klinika, Radiológiai Tanszék, Budapest
3Semmelweis Egyetem, Pulmonológiai Klinika, Budapest
4Semmelweis Egyetem, I. Számú Patológiai és Kísérleti Rákkutató Intézete, Budapest
BEVEZETÉS: A szolid daganatok mikrohullámú ablációját a klinikai gyakorlatban egyre gyakrabban alkalmazzák. Gold-standardnak a lézió épben történő sebészi eltávolítása tekinthető, a tumor elhelyezkedése vagy a páciens társbetegségei ezt kontraindikálttá tehetik.
A 18F-FDG PET/CT kiemelkedő jelentőséggel bír az ablációs kezelések tervezésében és a reziduális viabilis tumorszövet kimutatásában. Aspecificitása miatt azonban az abláció következtében átmenetileg kialakuló reaktív folyamatok, az esetleges szövődmények, illetve a reziduális viabilis tumorszövet elkülönítése nehézséget jelenthet, ezért a kontrollvizsgálatok időzítése kulcsfontosságú.
A tüdő daganatai esetében kevés irodalmi adat áll rendelkezésre a 24 órán belüli PET/CT-kontrollt illetően, az intézetünkben zajló kutatás többek között ennek jelentőségét vizsgálja.
Az alábbi esetismertetés betekintést nyújt az ablációs beavatkozás PET/CT alapján történő tervezésének és kivitelezésének menetébe, a 24 órán belüli kontroll felvételek jelentőségének vizsgálatába és az abláció következtében kialakuló reaktív folyamatok, illetve a reziduális viabilis tumorszövet elkülönítésébe.
A BETEG: A 68 éves férfi bal tüdejében planocellularis carcinoma igazolódott. Társbetegségei miatt műtét helyett az daganat mikrohullámú ablációja történt két alkalommal. A beteg szívelégtelenség következtében hunyt el a második intervenció után egy hónappal.
MÓDSZEREK: Az ablációs célterület és -térfogat meghatározását baseline PET/CT alapján végeztük. A kezeléseket követően 24 órán belül PET/CT-kontroll történt.
Az elkészült felvételeken szegmentáltuk a tumorokat (máj SUVmean*2 vágópont mentén), meghatároztuk a metabolikus tumorvolumen (MTV) értékét. Szegmentáltuk továbbá a beavatkozás után létrejött colliquatiós zónát (centrálisan a SUV: 0-1 közötti voxelhalmazokat).
A boncolás során nyert információk birtokában az eset kuriózumnak tekinthető. Az ablátum makroszkópos és mikroszkópos tanulmányozása rávilágít a látott kép kórélettani hátterére.
EREDMÉNYEK: A 24 órán belüli kontroll PET/CT-felvételeken a colliquatiós zónát inhomogén, diszkréten-mérsékelten fokozott radiofarmakon-felvétel övezte, amely a második ablációt követően a patológiai mikroszkópos vizsgálat során lymphocytás beszűrődésnek bizonyult. Ettől jól elkülönült egy körülírt, intenzív dúsítási többlet, amelyet reziduális tumorszövetnek tartottunk.
Összehasonlítva a baseline vizsgálattal, az I. abláció után 89%-os, a II. abláció után 81%-os volt a MTV csökkenése, amely azonban a sebészi terminológiával analóg módon mindkét esetben inkomplett ablációnak tekintendő (A1).
KÖVETKEZTETÉS: Korrigált szemikvantitatív mérések segíthetik a reaktív és reziduális FDG-dúsítás elkülönítését. Meghatározható ezáltal a beavatkozás sikeressége, lehetővé téve a minél korábbi adekvát terápiás lépést. A boncoláskor nyert információk rávilágítanak a PET/CT-n az ablátum letális zónájában megjelenő, a korrigált szemikvantitatív vágópont értékek alapján reaktív eredetűnek tartott eltérés hátterében meghúzódó immunológiai folyamatra, amely a hőhatás másodlagos következményeként létrejövő korai? lokális immunstimuláció és lymphocyta invázió.
5. 99mTc-MIBI szcintigráfiás vizsgálattal akcidentálisan felfedezett carcinoid tüdőtumor
Piroska Márton 1, Kiss Fanni Júlia 1, Vaszilkó Éva 1, Bús Katalin 1, Varga Zsolt 1, Györke Tamás 1
1 Semmelweis Egyetem, Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék
HÁTTÉR: A carcinoid tüdőtumorok ritka, jól differenciált daganatok, melyek két fő szövettani csoportra oszthatók: típusos és atípusos carcinoid; utóbbi általában agresszívebb viselkedésű, relapszusra hajlamosabb. A neuroendokrin tumorok leggyakrabban gasztrointesztinális és pulmonális kiindulásúak, egyéb anatómiai lokalizáció ritka. A szakirodalomban a MIBI szcintigráfiás vizsgálattal felfedezett carcinoid tumoros esetek raritásnak számítanak.
ESETBEMUTATÁS: Az alábbi eset egy ritka példája a 99mTc-MIBI (MIBI) szcintigráfiás vizsgálattal akcidentálisan felfedezett carcinoid tumoros folyamatnak. Az 54 éves nőbeteg anamnéziséből kiemelendő a hypercalcaemia hátterében kimutatott, 10 éve eltávolított mellékpajzsmirigy-adenoma. A műtétet követően a páciens normocalcaemiás lett, majd ismételt hypercalcaemia, emelkedett parathormonszint miatt került klinikánkra 2021.10.11-én. A MIBI szcintigráfiás vizsgálat során a pajzsmirigy bal lebenye mögött egy fokozott MIBI- felvételű lágyrészképlet ábrázolódott, amely lehetséges adenomára utalt; ezen kívül akcidentálisan a jobb tüdőben, a jobb emlőben, illetve több csontban szintén megfigyelhető volt emelkedett MIBI-halmozás, a CT-felvételen társuló morfológiai eltérésekkel.
Az adenomára gyanús laesióból vékonytű aspirációs cytológiai vizsgálatot végeztek, amellyel sem adenomát, sem malignus folyamatot nem sikerült kimutatni. A tüdőben lévő teriméből core biopszia során típusos carcinoid igazolódott, ennek kapcsán a beteg újfent klinikánkra érkezett staging céljából szomatosztatin-receptor és csontszcintigráfiás vizsgálatra (ezeket megelőzően egy másik intézetben 18F-FDG-PET/CT-vizsgálat is készült). A felvételek igazolták a tüdőből kiinduló, multiplex csontérintettséggel, makroszkóposan egygócú májmetastasissal és a jobb emlő érintettségével járó carcinoid tumoros folyamatot.
A jól differenciált (Krenning-score: 3-4, ki67 index: 1-2%) carcinoid tüdőtumor diagnózisát követően a beteg 4 ciklus CBD-etoposid kezelést kapott, majd restaging CT-vizsgálaton progressziót írtak le, emiatt a továbbiakban everolimus terápiát javasoltak.
KÖVETKEZTETÉS: Az alábbi eset egy ritka példája MIBI szcintigráfiás vizsgálattal akcidentálisan felfedezett carcinoid tumoros folyamatnak. Tekintettel arra, hogy a betegnél mellékpajzsmirigy adenomát nem sikerült igazolni, a hypercalcaemia egy lehetséges magyarázata lenne maga a tumoros folyamat, amelyre ugyan kevés szakirodalmi példa van, de felhívja a figyelmet a MIBI szcintigráfiás vizsgálaton szokatlan helyen jelentkező halmozási többletek egy lehetséges okára, ami egyben a klinikai eltéréseket is magyarázhatja. A mi esetünk kapcsán a fenti elmélet közvetett bizonyítására a carcinoid tumoros folyamat sikeres kezelését követően nyílik lehetőség.
6. FET PET-CT-vel végzett neuro-onkológiai vizsgálatok, esetek bemutatása
Szabó Péter
ScanoMed Orvosi Diagnosztikai, Kutató és Oktató Kft., Budapest
Bevezetés: A radioaktív izotóppal jelölt aminosavval végzett PET vizsgálatok jelentőségét az adja, hogy az onkológiában széleskörben alkalmazott FDG-PET szerepe az agydaganatok vizsgálatában az intenzív agyi háttéraktivitás miatt korlátozott. Ezzel szemben a legtöbb agytumor a normál agyszövetnél nagyobb aminosav-felvételt mutat. Hazánkban eddig 11C-metioninnal végeztek PET vizsgálatokat neuro-onkológiai célzattal, jelenleg 18F-DOPA és 18F-FET (O-(2-[18F] Fluoroethyl)-L-tyrosine) is elérhető.
Célkitűzés: Intézetünkben 2,5 évvel ezelőtt kezdtük el a FET PET-CT vizsgálatokat. Az előadásban összefoglaljuk a biológiai hátteret, az indikációkat, a leképezési protokollokat, a vizsgálat korlátait, a vizsgálatkérés lehetőségeit. Néhány jellemző eseten keresztül bemutatjuk eddigi tapasztalatainkat, saját beteganyagunkat.
Eredmények: Eddig közel 300 (átlagban havi 10) FET PET-CT vizsgálatot végeztünk, a vizsgált betegségek megoszlása: 93% – glioma, 5% – solid tumor metastasis, 2% – neurolymphoma. A vizsgálatok az alábbi indikációkban történtek: restaging/viabilitás megítélése (64%), benignus-malignus laesio elkülönítése és biopsia helyének kijelölése (21%), terápiás válasz megítélése (12%) és besugárzás tervezés (3%), melyek megfelelnek a nemzetközi ajánlásokban is szereplő fő indikációknak.
Megbeszélés: A FET PET-CT hatékony módszernek bizonyult az agyban megjelenő daganatok széles körének vizsgálatára, sok esetben kiegészítve, illetve eldöntve az MRI-vel nem egyértelmű képet.
7. 18F-fluorokolin PET/CT-n talált incidentális pulmonalis adenocarcinoma – esetismertetés
Fendrik Gyula Farkas1, Jánosa Cintia Barbara1, Vaszilkó Éva1, Gyebnár János2, Varga Zsolt1, Györke Tamás1
1Semmelweis Egyetem Orvosi Képalkotó Klinika, Nukleáris Medicina Tanszék
2Semmelweis Egyetem Orvosi Képalkotó Klinika, Radiológiai Tanszék
Háttér: A primer hyperparathyreosis gyakori endokrin megbetegedés, prevalenciája kb. 7/1000. Az esetek többségében solitaer mellékpajzsmirigy-adenoma áll a betegség hátterében, definitív terápiáját sebészi megoldás jelenti. A régió anatómiájából adódóan a műtét sikerességéhez, ill. invazivitásának minimalizálásához elengedhetetlen a mirigyek pontos preoperatív lokalizálása, melyben a nukleáris medicina kiemelkedő szerephez jutott. Két, erre a célra használt módszer a 99mTc-pertechnetát/ 99mTc-MIBI subtrakciós, ill. kimosásos módszer, valamint a 18F-fluorokolin-PET/CT.
Esetbemutatás: Az alábbi esetbemutatás egy olyan beteggel foglalkozik, akinél mellékpajzsmirigy adenoma lokalizálása során egy incidentális pulmonalis primer tumor is detektálásra került. A 70 éves nőbetegnél több éve diagnosztizáltak osteoporosist. Laborjaiban konstansan emelkedett parathormon-szint ill. kálcium-szint szerepel. Két évvel jelen megjelenése előtt, adenoma lokalizálása érdekében 99mTc-MIBI vizsgálatot végeztek, azonban a felvételeken mellékpajzsmirigy adenómára, illetve hyperplasiára utaló kóros halmozástöbblet nem ábrázolódott. Fél évvel később nyaki MRI vizsgálat során a bal pajzsmirigy lebenyben vetettek fel adenomát. Mivel biokémiailag továbbra is fennállt hyperparathyreosisa, kezelőorvosa ismételt izotópos képalkotó vizsgálatot javasolt. Vizsgálatát 99mTc-pertechnetát/99mTc-MIBI módszerrel végeztük, a felvételeken érdemi kóros eltérést nem találtunk. Egy évvel később, csípő TEP beültetés előtt javasolják mellékpajzsmirigy-túlműködésének szanálását. A műtéthez szükséges lokalizálást ezúttal 18F-fluorokolin PET/CT-vel végeztük. A módszerrel sikeresen detektáltunk egy mellékpajzsmirigy adenomát a pajzsmirigy jobb lebenye mögött, emellett azonban egy további fluorokolin-halmozó, malignitásra gyanús képlet is felfedezésre került a jobb tüdő alsó lebenyében. Az említett tüdőgóc diagnosztikus CT, majd mellkassebészeti vizsgálatát követően eltávolításra került, az eltávolított mintából T1b N0 adenoccarcinomát diagnosztizáltak. Tekintettel a korai stádiumra, további kezelésre nem volt szükség. Mellkassebészeti ellátását követően a beteg mellékpajzsmirigy adenomája is eltávolításra került, friss laborjában parathormon szintje normál tartományban van. A beteg jelenleg csípő TEP beültetésére vár.
Konklúzió: A primer hyperparathyreosis kezelésében az első lépés az eltérés lokalizálása, melyhez többféle módszer is rendelkezésünkre áll. Az egyik ilyen a 18F-fluorokolin-PET/CT, mellyel akár olyan esetekben is sikerrel járhatunk, amikor egyéb képalkotó eljárás (pl. 99mTc-MIBI szcintigráfia, MRI, UH) kudarcot vall. A módszer emellett esetünkben szekunder prevenciós eszközként is funkcionált, hiszen általa lehetőség nyílt betegünk második primer tumorának korai kezelésére.
8. Neurolyphomatosis diagnosztikája FDG-PET/CT-vel
Német Rita, Besenyi Zsuzsanna, Sipka Gábor, Farkas István, Gion Katalin, Horváth Zoltán, Pávics László
SZTE Nukleáris Medicina Intézet, Szeged
46 éves nőbetegnél bal oldali neuropathiás végtagfájdalom, izomgyengeség miatt indult kivizsgálás. Kezdeti lumbalis és sacrum gerinc MR vizsgálat kóros eltérést nem igazolt, elektorfiziológiai vizsgálat S1 gyöki neuropathiát véleményezett. Klinikum alapján gyulladásos vagy traumás eredet merült fel, konzervatív terápia indult. Autoimmun neuritis irányában készült laborok kóros eltérést nem igazoltak. Konzervatív terápiára jelentősebb javulás nem következett be, klinikumban lassú progresszió látszott. S1 gyöki lokális szteroid infiltráció csupán átmeneti enyhe javulást eredményezett. Kontroll MR képalkotó bal S1-2 gyöki, n. ischiadicus körülírt megvastagodását, kontrasztanyag halmozását véleményezte. 99mTc-HMPAO jelölt autológ leukocyta szcintigráfia gyulladásos folyamatra utaló halmozást nem igazolt. A térfoglaló folyamat metabolikus aktivitásának tisztázására készült FDG-PET/CT-n bal L.IV-S.II. ideggyökök, bal plexus ischiadicus mentén többgócú magas metabolikus aktivitású folyamatot, neurolyphomatosisnak valószínűsíthető eltérést igazolt, melyet az ezt követő szövettan is megerősített.
9. Aorta körüli tályog kimutatása FDG PET/CT-vel aortabillenytű cserén átesett betegben
Mikó Zsófia1, Nagy Viktória2, Besenyi Zsuzsanna1
1SZTE Szent-Györgyi Albert Klinikai Központ, Nukleáris Medicina Intézet, Szeged
2 SZTE Szent-Györgyi Albert Klinikai Központ, Belgyógyászati Klinika Déli Telephely, Szeged
A szív körüli gyulladásos folyamatok diagnosztikája billentyűcserén átesett betegeken sokszor kihívást jelent. Korábbi klinikai tapasztalatok bizonyítják, hogy transthoracalis (TTE) és a transoesophagealis echocardiográfia (TEE) mellett az FDG PET/CT is hasznos vizsgálómódszer, ha a klinikai kép alapján felmerül a graft körüli infekció gyanúja.
A 69 éves férfibeteg 2016-ban aortabillentyű endocarditis miatt esett át Biovalsalva graft implantation klinikánkon. Jelen kardiológiai osztályos felvételére szédülés, gyengeség, étvágytalanság, egy hónap alatt több, mint 10 kg-os súlyvesztés miatt került sor. A laborokban látott emelkedett gyulladásos paraméterek és a pozitív haemokultúra miatt antibiotikum terápiát indítottak. TTE vizsgálat az aorta fal körkörös megvastagodását mutatta. TEE vizsgálat során az aorta és a tricuspidalis billentyűn is vegetatio igazolódott. A beteg az osztályos észlelés alatt időnként ízületi panaszokat, bal bordaív és vesetáji fájdalmakat jelzett. A panaszok hátterében felmerülő septicus embolizáció kizárására, illetve az aorta tályog felderítése céljából FDG PET CT vizsgálatot végeztünk.
A vizsgálatot 24 órán át alkalmazott ketogén diéta, illetve 12 órás éhezés előzte meg. A radiofarmakon beadása előtt 50 IU/testtömegkilogram dózisban intravénás Heparint alkalmaztunk. A leképezést az FDG beadása után egy órával kezdtük. A szívről EKG kapuzott felvételeket is készítettünk. A vizsgálat során magas metabolikus aktivitású gyulladásos folyamat igazolódott az aorta ascendens területén az érfalon, mely jobb oldalon a ventralis pleurára terjedt. Kontroll TEE-n az aorta falában tályogüreg jelent meg. A beteg a Szívsebészeti Osztályra került, ahol Bentall műtétet hajtottak végre.
Az FDG PET/CT hatékony módszer a billentyűcserén átesett betegek vizsgálatára. Ebben a betegcsoportban a szakirodalom szerint a módszer szenzitivitása 86%, specificitása 84% cardiális infekciózus folyamatok kimutatásában.
10. Esetbemutatás: FDG-PET/CT szerepe Erdheim-Chester betegségben
Farkas Bence
Debreceni Egyetem KK Orvosi Képalkotó Klinika, Nukleáris Medicina és Scanomed Kft., Debrecen
Bevezetés: Az Erdheim-Chester betegség (ECD) egy ritka kórkép, mely a nem-Langerhans sejtes histiocytás kórképek részhalmazába tartozik. A pontos prevalencia ismeretlen, mindösszesen kb. 500 eset került leírásra az irodalomban. A diagnózis rendszerint későn kerül megállapításra, melynek oka a betegség ritka volta és változatos megjelenése. Több szervrendszert érinthet, a tüneteket és a lefolyást a dominánsan érintett szervek határozzák meg.
Esetismertetés: 52 éves férfibeteg, ismert a hypertonia és a 2-es típusú cukorbetegség, 2013-ban akut myocardialis infarctus zajlott. 2016 óta tartósan emelkedett gyulladásos értékek, visszatérő hőemelkedések, progrediáló nagy és közepes erek stenosisa, fogyás, visszatérő lázas állapot miatt vizsgálják. Colonoscopia, fogászati, fül-orr-gégészeti, bőrgyógyászati góckutatás negatív. Mellkas-has-kismedencei CT szintén nem talált érdemi eltérést. 2019-ben bal oldali a. renalis stenosis miatt intervenció történt. Gyulladásos értékei továbbra is magasak, quantiferon negatív, systémás immunbetegség kizárásra került. 2019 óta polyuriát és polydypsiát (napi 5-6 liter) említ. Térd és csuklófájdalmat panaszol. Esetleges vasculitis vagy gyulladásos góc megítélésére FDG-PET/CT vizsgálatot rendelnek.
Eredmények: FDG-PET/CT vizsgálat készült a koponyatetőtől a talpakig terjedő régióról. Mérsékelten megvastagodott parenchymájú jobb vese ábrázolódik. Mindkét oldalon dominánsan az alsó végtagokban a hosszú csöves csontok metaphysisében és diaphysisében, a bal os ileiben az SI-rés mellett intenzív FDG dúsulások láthatóak, identikusan helyenként gócos, scleroticus eltérések figyelhetőek meg. Mindkét oldalon a pectoralis maior izmok alsó harmadában, lapszerint elterülő, közepes-intenzív dúsulások láthatók. A dúsulásokkal identikusan az izmok mérsékelten vaskosabbak, kontúrjaik a zsírszövet felé elmosottak. Jobb oldalon a scapula mögött és lumbalisan paravertebralisan az izmok mentén és az izomzattól egyértelműen nem elkülöníthetően a subcutis beszűrt, FDG-t mérsékelten-közepesen dúsít.
Vélemény: Az összkép alapján Erdheim-Chester betegség lehetősége merül fel. Intenzív metabolikus aktivitású, scleroticus laesiok döntően a hosszú csöves csontok metaphysisében. Cutan és vázizom érintettség. Veseérintettség nem zárható ki.
Megbeszélés: A jobb distalis femurból mintavétel megerősítette az Erdheim-Chester betegséget. Irodalmi adatok alapján a kórkép 96%-ban mutat ossealis érintettséget, melynek jellegzetessége a „hot-knee pattern”: szimmetrikus, bilateralis intenzív tracer-halmozás a hosszú csontokban a térdek körül, identikusan scleroticus mintázattal. 38%-ban orbitaérintettség és exophtalmus is előfordulhat (jelen esetben nem volt). Gyakori még a központi idegrendszeri, hypophysis, cardiovascularis, perirenalis, bőr és tüdőérintettség, melyek egy része jelen esetben is észlelhető volt.
Jelen eset bemutatja, hogy a teljes test FDG-PET/CT fontos szerepet játszhat az ECD diagnosztikájában, a betegség kiterjedtségének megítélésében, valamint a gócok aktivitásának változása az alkalmazott terápia hatékonyságának megítélésére is alkalmassá teszi.
11. Erdheim-Chester betegség diagnosztikája
Bakos Annamária1, Czékus Tamás1, Farkas István1, Hemelein Rita2, Kovács László2, Mikó Zsófia1, Nagy Szanella1, Német Rita1, Pávics László1, Sipka Gábor1, Besenyi Zsuzsanna1
1Szegedi Tudományegyetem Nukleáris Medicina Intézet
2Szegedi Tudományegyetem Reumatológiai és Immunológiai Klinika
Negyvenöt éves férfibeteg anamnézisében 2019-ben microcyter anaemia és emelkedett C-reaktív protein érték igazolódott kezdetben klinikai tünetek nélkül. A betegnek fül-orr gégészeti, urológiai és gasztroenterológiai góckutatása történt, ahol kóros eltérést nem igazoltak. A betegnél nagyfokú gyengeség, jelentős fogyás valamint térdízületek területén kifejezett fájdalom jelentkezett, a szemhéjakon xanthelasmák jelentek meg. Tumormarkerek (CEA, CA 19-9, CA 72-4, AFP) normál tartományon belül voltak, autoimmun folyamatra utaló kóros vérkémiai eltérés nem igazolódott. 2021. január 29-én 18F-FDG PET/CT vizsgálat készült ismeretlen eredetű gyulladás okának kivizsgálása miatt, mely során a jobb scapulán és a hosszú csöves csontokban -alsó végtagi dominanciával- endostealis-intramedullaris sclerosisnak megfelelően fokozott metabolikus aktivitású folyamatot mutattunk ki. Csontszcintigráfia vizsgálat során a jobb scapulán fokális valamint alsó végtagi dominanciájú szimmetrikus, fokozott osteoblast aktivitást detektáltunk, a radiofarmakon dúsulási mintázata Erdheim-Chester betegség gyanúját vetette fel, melyet szövettani vizsgálat erősített meg.
12. Multiplex tüdőgócok diagnosztikája egy rheumatoid arthritisben szenvedő betegben
Német Rita, Czékus Tamás, Sipka Gábor, Farkas István, Bakos Annamária, Pávics László, Besenyi Zsuzsanna
Szegedi Tudományegyetem Nukleáris Medicina Intézet, Szeged
Több éve reumatoid arthritissel kezelt 62 éves férfibeteg kontroll mellkas röntgen vizsgálata során látott kerekded transzparencia csökkenés miatt indult kivizsgálása. Diagnosztikus mellkas CT vizsgálat többgócú lágyrészképletet igazolt a tüdőkben. A beteg korábbi anaemneziséből kiemelendő több évvel ezelőtti superficiálisan terjedő melanoma eltávolítása. A metastasis gyanús pulmonalis eltérések eredetének tisztázására az egyik lézióból CT vezérelt biopsziás mintavételezés történt. Szövettani eredménye necrotisáló granulomatosus gyulladást írt le, mely alapján a tüdőkben látott eltéréseket rheumatoid csomóknak véleményeztek, komplex antirheumatikus terápiát indítottak. A terápia ellenére kontroll képalkotó vizsgálatok során a tüdőgócok progressziója igazolódott. A léziók metabolikus aktivitásának megítélésére készült FDG PET/CT vizsgálat többgócú magas metabolizmusú pulmonalis léziókat, bihilarisan aktív nyirokcsomókat véleményezett. A klinikai kép és a terápia hatástalansága miatt az ismételt mintavétel PET/CT vezérelten a legmagasabb metabolikus aktivitást mutató lézióból történt, mely szövettani eredménye laphámcarcinoma (metachron II. primer malignus tumor) diagnózisát állította fel.
13. Adenoid cystcius carcinoma vizsgálata 99mTc-PSMA-SPECT/CT-vel
Farkas István, Sipka Gábor, Bakos Annamária, Czékus Tamás Mikó Zsófia, Német Rita, Besenyi Zsuzsanna, Pávics László
SZTE – ÁOK Nukleáris Medicina Intézet, Szeged
44 éves férfi beteg rekurrens szövődményes jobb oldali arcüreg gyulladás miatt kereste fel a fül-orr-gégészetet. Orrmelléküreg-CT felvétele koponya csontokat érintő Paget-kór lehetőségét. Bal oldali FES műtétet végeztek, mely során a csontszövetből mintát vettek. Az arcüreg biopsiás mintában a csontot infiltráló adenoid cystcius carcinoma igazolódott. A koponya MRI vizsgálat mellett PSMA-SPECT/CT készült. A bal orrüregben és paranasalis sinusokban PSMA pozitív infiltratív jellegű, a csontokat destruáló primer tumor igazolódott, mely miatt definitív sugárkezelést javasoltak. A PSMA-SPECT és topometriás CT regisztrációját és fúzióját követően, a funkcionális információkat figyelembe véve határoztuk meg a besugárzási céltérfogatot. Az irradiáció után a 6 hónapos követés során megvizsgáltuk a primer elváltozás PSMA expressziójában morfológiájában bekövetkező változásokat.
14. Multiplex májmetastasist adó neuroendocrin pancreas daganat komplex kezelése – esetismertetés
Libor László1, Bakos Annamária2, Besenyi Zsuzsanna2, Géczi Tibor1, Hőhn József1, Dr.Kovács Gabriella5, Pávics László2, Petri András1, Szepes Zoltán3, Torday László4, Vasas Béla6, Tiszlavicz László6, Lázár György1
1Szegedi Tudományegyetem Általános Orvostudományi Kar Sebészeti Klinika
2Szegedi Tudományegyetem Általános Orvostudományi Kar Nukleáris Medicina Intézet
3Szegedi Tudományegyetem Általános Orvostudományi Kar I.sz. Belgyógyászati Klinika
4Szegedi Tudományegyetem Általános Orvostudományi Kar Onkoterápiás Klinika
5Szegedi Tudományegyetem Általános Orvostudományi Kar Radiológiai Klinika
6Szegedi Tudományegyetem Általános Orvostudományi Kar Pathologiai Intézet
A neuroendokrin tumorok jellegzetes szövettani sajátosságokkal rendelkező ritka elváltozások. Incidenciájuk folyamatosan emelkedik. Jellemzőjük a hosszú kórlefolyás, és a daganat hormontermelő tulajdonságaitól függő változatos klinikai tünetek. A pancreas daganatok mindössze 5 százalékát kitevő neuroendokrin tumorok (Pan-NET) 70-90%-a nem funkcionál. Diagnózisukban – a konvencionális képalkotó eljárások mellett fontos szerep jut az izotóp diagnosztikának is. A kuratív sebészi beavatkozás lokálisan előrehaladott, vagy metasztatikus betegség esetén is elvégezhető.
Esetbemutatás: a 45 éves nőbeteg bizonytalan hasi panaszok miatt indított kivizsgálása grade 1. neuroendokrin tumort igazolt, a multiplex májmetastasist adó pancreas-farok neuroendokrin tumort szomasztoszatin receptor szcintigráfiával mutattuk ki. A betegnél szomatosztatin-analóg kezelés indult. Preoperatívan funkcionális volumetria (99mTc-Mebrofenin-SPECT/CT) vizsgálat során meghatároztuk a reziduális májtérfogat funkcióját (FLRV-f), melynek alacsony értéke miatt többlépcsős műtét mellett döntöttünk. Első lépésben distalis pancreas resectiot végeztünk splenectomiával, valamint bal lebenyi metastasectomiát, radiofrekvenciás ablációt és jobb vena portae ligaurát. Hét héttel később kontroll funkcionális volumetriát követően jobb hemihepatectomia történt az FLRV-f megfelelő növekedési dinamikájának köszönhetően. A beteget a 6. posztoperatív napon panasz-, és szövődménymentesen otthonába bocsátottuk. Az eset kapcsán elmondható, hogy a neuroendokrin tumorok terápiájában a lokális, lokoregionális betegségek mellett a metasztatikus esetek kezelésében is sebészi megoldás lehet az elsődlegesen választandó eljárás. Interdiszciplináris együttműködéssel előrehaladott daganatok kezelésében is akár hosszú távú sikerek érhetőek el.
15. F-DOPA PET/CT vizsgálat jelentősége MEN-2A szindrómában (esetismertetés)
Sipka Gábor (1), Besenyi Zsuzsanna (1), Gion Katalin (1), Mikó Zsófia (1), Valkusz Zsuzsanna (2), Pávics László (1)
1: Szegedi Tudományegyetem Nukleáris Medicina Intézet
2: Szegedi Tudományegyetem Belgyógyászati Klinika, Endokrinológiai munkacsoport
Egy 41 éves nőbetegben, akinél fiatal felnőttkorban genetikailag megerősített MEN-2A szindróma igazolódott medulláris pajzsmirigy karcinomával és pheokromocitómával, a nyaki és hasi műtéteket követően fokozatosan emelkedő kalcitonin szintet észleltek. A laboreltéréseken kívül érdemi panasz nem jelentkezett. Az évek alatt folyamatosan készülő konvencionális radiológiai képalkotó eljárások során körülírt, morfológiai eltérés nem igazolódott. Intézetünkben a jelentősen emelkedett kalcitonin szint miatt F-DOPA PET/CT vizsgálat mellett döntöttünk, mely nem várt lokalizációban, a jobb csípőcsont acetabularis felszínén jelzett fokozott F-DOPA akkumulációt. A diagnosztikát követően ortopédiai műtét történt, mely igazolta az évek óta növekedő tumormarker hátterében megbújó medulláris pajzsmirigyrák áttétét.
16. PSMA expresszáló mediastinalis incidentaloma – esetismertetés
Czékus Tamás
Szegedi Tudományegyetem Nukleáris Medicina Intézet
Egy 60 éves férfibetegnél vizelési panaszok miatt indult kivizsgálása, mely hátterében prosztata malignus tumora igazolódott. A radikális prosztatectomiát követő emelkedő PSA értékek további tisztázására készült 99mTc-PSMA SPECT/CT vizsgálat során a prosztataágyban reziduális folyamat igazolódott, melyen kívül leírásra került a bal alsó paratracheális régióban egy axiálisan 18x15mm-es intenzív PSMA expressziót mutató lágyrészképlet is. Mediastinális blokk dissectiot követően a szövettan az alapbetegség távoli manifesztációja helyett, új primer tumort igazolt.
17. Kiterjedt csontmet nagy dózisú 131I radiojóddal történő terápiás menedzselése: esetismertetés
Nagy Szanella (1), Sipka Gábor (1), Mikó Zsófia, Farkas István (1), Czékus Tamás (1), Német Rita (1), Besenyi Zsuzsanna (1), Valkusz Zsuzsanna (2), Pávics László (1)
(1) Szegedi Tudományegyetem Nukleáris Medicina Intézet
(2) Szegedi Tudományegyetem Belgyógyászati Klinika, Endokrinológiai Munkacsoport
Egy 63 éves férfibeteg kórelőzményéből kiemelendően korábban multinodularis toxikus golyva műtéti megoldása gyanánt total thyreoidectomián esett át, majd több évvel később jelentős mértékű súlyvesztés miatt belgyógyászati osztályos felvételre került. Panaszai között egy rossz mozdulat óta növekvő, fájdalmas, csecsemőfej méretű duzzanat is szerepelt, mely a jobb csípőcsontot érintette. A nyaki ultrahang és a laborértékek alapján pajzsmirigy szcintigráfiás vizsgálatot végeztünk, amely autonóm pajzsmirigy adenomát igazolt. A jobb csípőcsonton lévő képletről RTG felvétel alapján felmerült, hogy malignus, csontot destruáló folyamat következménye. Azonban, a szövettani vizsgálat meglepő módon papillaris pajzsmirigy carcinoma csontmetasztázisát véleményezte. A rendkívül előrehaladott betegség kezelésében egyedüliként csak a többszöri nagy dózisú radiojód kezelés jelenthetett megoldást.
18. FDG PET-CT alkalmazási elvei myeloma multiplexben két tanulságos eseten szemléltetve
Nagy Petra1, Szabó Péter1, Mikala Gábor2
1Scanomed Kft., Budapest
2Dél-pesti Centrumkórház – Országos Hematológiai és Infektológiai Intézet, Budapest
A jelenlegi nemzetközi irányelvek myeloma multiplexben hangsúlyozzák az FDG PET-CT szerepét, mely vizsgálattal lehetővé válik az intramedullaris és extramedullaris betegség detektálása, a solitaer plasmocytoma és myeloma multiplex elkülönítése, illetve „smoldering” myeloma esetén FDG PET-CT-vel igazolható annak progressziója aktív betegséggé. Ezáltal sok esetben a vizsgálatnak meghatározó szerepe van a beteg terápiájában. Elsődleges az FDG PET-CT a myelomás megbetegedések utánkövetésében, a terápiás válaszértékelésben, illetve a prognózis megállapításában.
Első esetünk a betegség egy klasszikusabb megjelenési formáján keresztül bemutatja egyrészt az FDG PET-CT szerepét solitaer plasmocytoma kezdeti diagnózisakor. A betegnél készült első, kezelés előtti vizsgálat célja a multiplicitás megítélése volt. A beteg második PET-CT vizsgálata kiemeli az ASCT előtti interim vizsgálat jelentőségét, melynél a lymphomás betegségekhez hasonlóan alkalmazható a Deauville kritériumrendszer, valamint rámutat az FDG PET-CT hasznára az ú.n. “measurable residual disease” kimutatásában. Betegünknél az interim PET-CT-n jó fokú regressio mellett CMR nem jött létre, még FDG-avid gócokat láttunk a femurban, az igazolt csontléziónak megfelelően, ezért az ASCT előtt irradiációs kezelésben részesült.
A második esetünk különlegességét adják a betegség szokatlan megjelenési lokalizációi: mindkét oldali emlőérintettség, mellkasfali-pleuralis terime, buccalis góc. Az ennél a betegnél készült FDG PET-CT vizsgálatok már relapsus után történtek, jelentőségüket elsősorban a terápiás válaszértékelés kapcsán láthatjuk. A PET-CT-n látható progressio miatt többedvonalbeli kezelések váltak szükségessé. Az eset rámutat az FDG PET-CT egyik legfőbb limitációjára, vagyis hogy a diffúz csontvelő infiltratio megítélésére korlátozottan alkalmas, hiszen a diffúzan fokozott csontvelői aktivitás hátterében reaktív eredet is állhat. A második eset további, mellékes érdekessége, hogy a betegünknél időközben pajzsmirigy carcinoma is kiderült, azonban a pajzsmirigyben kóros FDG dúsulást nem láttunk. Ez jól példázza, hogy a jól differenciált pajzsmirigytumorok sok esetben igen alacsony FDG-aviditásúak. Végül az eset alátámasztja, hogy az FDG PET-CT myelomás betegeknél jelentős prognosztikai értékkel bír. A PET-CT vizsgálatokon látható perzisztáló FDG felvétel korrelált a rossz kimenetellel, és a beteg sajnos a kitartó kezelések ellenére elhunyt.
A két eset a nemzetközi irányelvekkel összhangban alátámasztja, hogy az FDG PET-CT myelomás megbetegedések vonatkozásában nélkülözhetetlen képalkotó modalitás.
2022. május 21. szombat, 09:00 – 10:00, Preklinikai vizsgálatok
1. Galektin-3 fehérjét expresszáló melanoma sejtek kimutatására alkalmas laktóz-amin alapú radiofarmakonok szintézise és preklinikai vizsgálata
Gyuricza Barbara1,2, Szűcs Ágnes1, P. Szabó Judit1,3, Arató Viktória1,4, Dániel Szücs1,2, Szikra Dezső1, Trencsényi György1, Fekete Anikó1
1: Debreceni Egyetem, ÁOK Orvosi Képalkotó Intézet Nukleáris Medicina Nem Önálló Tanszék, Debrecen
2: Debreceni Egyetem, Kémiai Tudományok Doktori Iskola, Debrecen
3: Debreceni Egyetem, Klinikai Orvostudományok, Debrecen
4: Debreceni Egyetem, Gyógyszerészeti Tudományok Doktori Iskola, Debrecen
Bevezetés: A galektin-3 (Gal-3), a lektinek csoportjába tartozó fehérje, mely képes felismerni a különböző glikokonjugátumokban található β-galaktozidokat. Az extracelluláris Gal-3 részt vesz az áttétképzés, valamint az angiogenezis folyamatában, ezenkívül elősegíti a neoplasztikus sejtek adhézióját, migrációját, valamint invázióját. Az intracelluláris Gal-3 pedig az apoptózis folyamatát szabályozza. Ezért a Gal-3 prognosztikus, valamint diagnosztikus markere lehet ezt a receptort expresszáló tumortípusoknak, például a melanomának. A Gal-3 természetes liganduma a laktózamin, de galaktóz egységének C-3’ helyzetben történő kémiai módosítása növeli a kötődést. A kutató munka célja olyan radiofarmakon tervezése volt, mely alkalmas a Gal-3 receptor kimutatására. Ezen kívül előállítottunk egy heterodimer radiotracert is, amely képes kötődni mind a Gal-3, mind az αvβ3 integrin receptorokhoz. Az αvβ3 integrin receptor fontos szerepet tölt be az érképződésben, és az áttétképzésben. Az RGD (arginin-glicin-aszparaginsav) peptid származékok specifikusan képesek kötődni hozzá, ennek köszönhetően pozitronsugárzó radionukliddal jelzett származékai alkalmasak az αvβ3 integrin expressziójának azonosítására PET képalkotással.
Módszerek: Először egy azidopropil aglikonnal rendelkező laktózamin származék galaktóz egységének 3’-OH csoportját sztannilén-acetálon keresztül szelektíven (2-naftil)-metileztük. Majd a védőcsoportok eltávolítása után a laktózamin analóg amino csoportja és bifunkciós p-SCN-Bn-DOTAGA kelátor izotiocianát csoportja között tiokarbamid kötést hoztunk létre. Az így előállított molekulát egyrészt prekurzorként alkalmaztuk, másrészt ezt a vegyületet rézmentes gyűrűfeszültség indukálta klikk reakcióval konjugáltuk a c(RGD-D-Phe-K) peptidhez. Ezt követően megvalósítottuk a standardként alkalmazott DOTAGA-cRGD prekurzor szintézisét is. Megvalósítottuk az előállított prekurzorok 68Ga izotóppal történő radiokémiai jelzését, meghatároztuk a radiojelzett vegyületek oktanol-víz megoszlási hányadosát, valamint elvégeztük a radiotracerek stabilitás vizsgálatát is. Az előállított radiofarmakonok biológiai vizsgálatát kontroll, és B16F10 sejtvonallal subcutan injektált C57BL6 egereken végeztük.
Eredmények: Sikeresen előállítottuk a [68Ga]Ga-DOTAGA-cRGD, [68Ga]Ga-DOTAGA-LacN(NAP)-PrN3, valamint a [68Ga]Ga-DOTAGA-LacN(NAP)-cRGD radiofarmakonokat, melyek radiokémiai tisztasága >99%. Meghatároztuk a radiotracerek logP értékét is, mely alapján arra következtethetünk, hogy az előállított radiojelzett vegyületek hidrofil tulajdonságokkal rendelkeznek, tehát a vesén keresztül ürülnek. A kapott eredmények összhangban voltak a szervieloszlás vizsgálatok eredményével. A szérumstabilitási vizsgálat alapján mindhárom radiofarmakon 2 óra elteltével is stabil maradt. A miniPET felvételek alapján megállapítható, hogy mindhárom radiotracer alkalmas a B16F10 melanoma kimutatására.
2. In vivo analysis of HER2 receptor status with 52Mn-DOTAGA-trastuzumab radiopharmaceutical
Toan Minh Ngo1, Nagy Tamás1, Nagy Gábor2, Garai Ildikó2, Vágner Adrienn2
1Debreceni Egyetem Klinikai Központ Orvosi Képalkotó Klinika Nukleáris Medicina Intézet, Debrecen
2Scanomed Kft, Debrecen
Background: Assessing HER2 receptor status is essential in the selecting candidates for targeted therapy and monitoring therapy repsonses. Having high resolution, PET imaging using radiolabeled HER2 specific antibody can be a practical method replacing invasive biopsy in determing level of HER2 expression. The isotope 52 Manganese can be an innovative low energy beta emitter that has suitable half life for both radiolabeling and antibody clearance rate in vivo.
Aim: In our work, we aimed to investigate the distribution of trastuzumab labeled with a 52Mn positron-emitting isotope in HER2 negative and HER2 positive human breast carcinoma cells injected into immunodeficient mice using hybrid PET/CT and PET/MRI cameras.
Methods: 100 μL of tumor cell suspension was subcutaneously injected into the back of mice, including the breast in the case of HER+ cell lines. The tumour growth time was 3-4 weeks. PET/MRI and PET/CT scans were performed at 7 time points (4, 24 h and 2, 3, 5, 7, 10 days) following intravenous administration of 4 MBq 52Mn-DOTAGA-trastuzumab. Activity was characterized by SUVmax and SUVmean measured in 3 mm diameter VOI. We evaluated the temporal distribution of radiopharmaceuticals in different organs, examined the uptake of tumor activity in relation to blood pool and liver activity in HER2 positive and HER2 negative cell line tumors.
Results: In the HER2 positive cell line, the indicated trastuzumab reached its maximum activity in the tumour 4 hours after injection. However, increasing activity over time was also observed in HER2 negative tumour tissue. In the circulation, and in the parenchymal organs tested activity decreased over time, and with muscle showing minimal activity in mice injected with both cell lines. When HER2 positive cell lines were examined, tumour tissue growing in the breast showed higher isotope uptake.
Conclusion: Our results suggest that 52Mn-DOTAGA-trastuzumab is suitable for in vivo organ distribution studies and characterization of HER2 expression in tumors.
3. APN/CD13 és αvβ3 integrin receptorok in vivo vizsgálata szingenikus tumoros állatmodellen
Péliné Szabó Judit1,2, Borgyos Stella1, Arató Viktória Zsófia1, Stéfánné Dénes Noémi1, Kis Adrienn1, Kálmán Szabó Ibolya1, Farkasinszky Gergely1, Opposits Gábor1, Kertész István1, Balkay László1, Hajdu István1,2, Trencsényi György1,2
1Debreceni Egyetem, Általános Orvostudományi Kar, Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék, Debrecen
2Debreceni Egyetem, Klinikai Orvostudományok Doktori Iskola, Debrecen
Bevezetés: A rosszindulatú daganatos betegségek okozta halálozás fő okai a metasztázisok. Az elmúlt évek metasztatikus kaszkádot érintő kutatásainak egyik nyitott kérdése, hogy a metasztázisok adnak-e áttétet vagy minden áttét a primer lézióból származik. A daganatok áttétképzésének egyik fontos kiváltója a hipoxia és az ennek hatására meginduló angiogenezis. Vizsgálataink során a neo-angiogenezis molekulái közül az αvβ3 integrin és APN/CD13 expressziójának mértékét vizsgáltuk in vivo PET képalkotással egy olyan szingenikus daganatos patkány modellben, amelyben az áttétképzés folyamata jól követhető. Munkacsoportunk e modell alkalmazásával korábban már igazolta, hogy a neo-angiogenezis folyamata, illetve az ezzel összefüggésben expresszálódó αvβ3 integrin és APN/CD13 expressziója jól vizsgálható in vivo PET képalkotással 68Ga-jelzett RGD és NGR peptidekkel.
Módszerek: Kutatásunkhoz nőstény Fischer-344 (n=18) patkányokat használtunk. A dagantok indukálásához a capsula renalison egy lyukat ejtettünk, melyen keresztül Gelaspon korongon 1×106 Ne/De kémiailag indukált mesoblastos nephroma sejtet ültettünk be a kísérleti állatok vesetokja alá. Az így keletkező primer tumor mellkasi metasztázisát ültettük tovább egy másik patkány vesetokja alá. A daganatok azonosítása 18FDG-vel, míg a αvβ3 integrin és APN/CD13 kimutatása 68Ga-NODAGA-RGD és 68Ga-NOTA-cNGR radiotracerekkel történt intravénás injektálás után a Nukleáris Medicina Tanszék épületében található kisállat PET (MiniPET-II) készülék alkalmazásával. A rekonstruált képeket BrainCAD képelemző program segítségével értékeltük ki. Az elváltozások radiofarmakon halmozását a standardizált felvételi érték (SUV=Standardized Uptake Value) alkalmazásával karakterizáltuk.
Eredmények: A vesetok alá ültetett Ne/De daganatok és metasztázisok αvβ3 integrin és APN/CD13 expressziója 68Ga-NODAGA-RGD és 68Ga-NOTA-cNGR radiotracerekkel – ha eltérő mértékben is, de – azonosíthatóak voltak preklinikai PET vizsgálatokkal. A vizsgált angiogenikus molekulák közül az αvβ3 integrin expressziója minden esetben alacsonyabb volt, mint az APN/CD13 kifejeződés mind a primer, mind pedig a metasztázisok tekintetében. Megfigyelhető volt azonban, hogy a sorozatos átültetések folyamán mind a vesetok alatt növekedő daganatok, mind pedig a mellkasi áttétek 18FDG, 68Ga-NODAGA-RGD és 68Ga-NOTA-cNGR halmozása folyamatos emelkedést mutatott.
Következtetés: Vizsgálatainkban az áttétek folyamatos továbbültetése során a kialakuló daganatok és az abból adódó áttétek fokozódó glükóz metaboliznusa, valamint a neo-angiogenezissel összefüggő αvβ3 integrin és APN/CD13 molekulák expressziójának emelkedése erősödő malignitást jelezhet az általunk használt modellben.
4. 68Ga és 205/206Bi jelzett, albuminkötő egységgel módosított DOTA-konjugált NAPamid szintézise és preklinikai vizsgálata
Szűcs Dániel1,2,3, Szabó Judit1,4, Arató Viktória Zsófia1,5, Gyuricza Barbara1,3, Szikra Dezső1, Trencsényi György1, Tóth Imre2, Fekete Anikó1
1 Debreceni Egyetem, ÁOK Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék, Debrecen
2 Debreceni Egyetem, TTK Fizikai Kémiai Tanszék, Debrecen
3 Debreceni Egyetem, Kémiai Tudományok Doktori Iskola, Debrecen
4 Debreceni Egyetem, Klinikai Orvostudományok, Debrecen
5 Debreceni Egyetem, Gyógyszerészeti Tudományok Doktori Iskola, Debrecen
Bevezetés: Az alfa melanocita-stimuláló hormon (α-MSH) fokozza a melamin képződését a melanocortin-1 receptorhoz kötődve. A NAPamid peptid, mint α-MSH analóg specifikusan kötődik ehhez a receptorhoz, amely jelentős expressziót mutat a melanotikus melanoma sejtekben. A melanoma az egyik legagresszívabb bőrrák típus. A célzott alfa terápia egyre inkább a tudományos és a klinikai érdeklődés középpontjába kerül, ezért a kutatás célja alfa sugárzó 213Bi izotóppal jelölt, DOTA-konjugált NAPamid származékok szintézise preklinikai terápiás vizsgálatokhoz. Az ismert radiojelzett NAPamid származékok viszonylag jó tumor felvétellel, ugyanakkor magas vese felvétellel és gyors kiürüléssel jellemezhetőek. A DOTA-NAPamid kémiai felépítését albuminkötő egység, nevezetesen 4-(p-jód-fenil)-butánsav bevezetésével módosítottuk és ennek hatását vizsgáltuk a tumor- és a vesefelvételre in vivo PET képalkotással és ex vivo biodisztribucióval.
Módszerek: A kémiai szintézis során a gyantához kapcsolt védőcsoportokkal ellátott NAPamid molekulához egy megfelelően védett lizint kapcsoltunk. Ezt követően az Fmoc védőcsoportot eltávolítottuk és 4-(p-jód-fenil)-butánsavval konjugáltunk. A Dde védőcsoport eltávolítása után DOTA-trisz(t-Bu)észtert kapcsoltunk a peptidhez. Triflur-ecetsavas kezelés után nyertük a prekurzor molekulát, amelyet szemipreparatív HPLC-vel tisztítottuk és szerkezetét tömegspektroszkópiával igazoltuk. Az így kapott Napamid származékot ciklotronban előállított 68Ga, valamint 205/206Bi izotópokkal jelöltük. A 213Bi izotóp limitált elérhetősége miatt 205/206Bi izotópot használtunk az előzetes preklinikai vizsgálatokhoz. A jelölt vegyületeket szilárdfázisú extrakcióval tisztítottuk. Elvégeztük a tisztított vegyületek szérum stabilitás vizsgálatát. Az in vivo és ex vivo vizsgálatok során C57BL6 egereket és B16F10 sejtvonalat használtunk. A 68Ga izotóppal jelzett radiofarmakon esetében szervi megoszlás vizsgálatot és PET felvételt késztettünk, míg a 205/206Bi izotópokkal jelzett radiofarmakon esetében csak szervi megoszlás vizsgálat történt.
Eredmények: Sikeresen előállítottunk és 68Ga, valamint 205/206Bi izotópokkal radiojeleztünk egy 4-(p-jód-fenil)-butánsavval módosított DOTA-konjugált NAPamid származékot. A tisztított jelölt vegyületek radiokémiai tisztasága (RCP) nagyobb volt, mint 98%. A preklinikai vizsgálatok még folyamatban vannak, de az előzetes eredmények alapján azt mondhatjuk, hogy az albuminkötő egység bevezetése növelte a tumorfelvételt és csökkentette a vesefelvételt, ezek előnyösek a radioterápia számára. Ugyanakkor meg kell jegyeznünk, hogy a radiotracerek injektálása után 90 perccel a vérbő szervek radiofarmakon felvétele is jelentős volt a megnövekedett keringési idő miatt.
Köszönetnyilvánítás: Köszönjük a Nemzeti Kutatási, Fejlesztési és Innovációs Hivatal (NKFIH K-128201) anyagi támogatását.
5. Gallium-68 jelölt ciklodextrin származékok előállítása és preklinikai vizsgálata.
Csige Katalin1,2, Péliné Szabó Judit1, Arató Viktória Zsófia1, Stéfánné Dénes Noémi1, Kálmán Szabó Ibolya1, Kertész István1, Balkay László1, Fenyvesi Ferenc3, Trencsényi György1, Hajdu István1,2
1Debreceni Egyetem, Általános Orvostudományi Kar, Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék, Debrecen
2Debreceni Egyetem, Gyógyszerészeti Tudományok Doktori Iskola, Debrecen
3Debreceni Egyetem, Gyógyszerésztudományi Kar, Gyógyszertechnológiai Tanszék, Debrecen
Bevezetés: A ciklodextrinek csonka kúp alakú semleges glükóz oligomerek. Kiváló gyógyszerhordozó tulajdonságaik mellett egyes β-ciklodextrinek önmagukban is gyógyszernek minősülnek. Ilyen pl a hidroxipropil-béta-ciklodextrin (HPBCD), melyet az úgynevezett Niemann-Pick ritka gyógyíthatatlan gyermekbetegség terápiájában használnak, illetve a random metilezett béta-cilkodextrin (RAMEB), amely az ízületi gyulladásos fájdalom csillapításában használható. Mindezeken túl korábbi kutatások arról számoltak be, hogy bizonyos ciklodextrin származékok mint pl. a RAMEB nagy affinitást mutatnak a daganatok által expresszált, PGE-2-vel történő komplexképzés felé. A ciklooxigenáz-2 (COX-2)/prosztaglandin E2 (PGE2) fontos szerepet játszik a tumorok áttétképzésében és fejlődésében. Mivel a PGE2 számos daganatellenes terápia alapja, hasznos célpont lehet a tumor diagnosztizálásában is, pozitron emissziós tomográfia (PET) képalkotó eljárás során.
Módszerek: HPBCD-t illetve RAMEB-et p-NCS-benzil-NODA-GA kelátorral konjugáltuk, majd a kapott vegyületek szerkezetét analitikai RP-HPLC rendszerrel elemeztük és nagy felbontású tömegspektrometriával ellenőriztük. A NODAGA-HPBCD-t és NODAGA-RAMEB-et 68Ga-al jelöltük, meghatároztuk a radiokémiai tisztaságot (RCP%), megoszlási koefficienst (LogP) és az in vitro-in vivo stabilitást. Az in vivo biológiai eloszlás, a farmakokinetikai tulajdonságok és a tumor specifikusság értékeléséhez BxPC-3 és PancTu-1 tumort hordozó CB17 SCID egereket, és egészséges kontrol egereket használtunk. A jelölt farmakonok intravénás injekciója után az eloszlást és halmozódást ex vivo gamma counterrel és in vivo pozitron emissziós tomográfiával (PET) vizsgáltuk. A tumorok PGE2 expresszióját immunhisztokémiai módszerrel igazoltuk.
Eredmények: Az általunk szintetizált 68Ga-NODAGA-HPBCD és 68Ga-NODAGA-RAMEB esetén a radiokémiai tisztaság (RCP%) 98%-nál magasabb, a moláris aktivitás 15,5 GBq/μmol, a LogP, −3,5 körül volt. Hidrofil tulajdonságai miatt a farmakonok főleg a húgyúti rendszer által választódtak ki. Az in vivo és ex vivo szervi megoszlásos vizsgálatok a 68Ga-NODAGA-RAMEB esetében nagy felhalmozódását mutatták PGE2 pozitív BxPC-3 daganatokban; megközelítőleg 15-20-szor magasabb felvételt figyeltünk meg, mint a háttérben. Más szervek és szövetek radiotracer felvétele nagyon alacsony volt, és gyors kimosódást mutattak.
Következtetés: Az újonnan szintetizált 68Ga-NODAGA-RAMEB specifikus kötődést és nagy felhalmozódást mutatott a BxPC-3 tumorokban. Magas specificitásának, érzékenységének és a gyors kiürülésnek köszönhetően a 68Ga-jelölt RAMEB ígéretes radioaktív nyomjelző a PGE2 pozitív daganatok PET diagnosztikájában. A kutatómunka a Magyar Tudományos Akadémia, Bolyai János Kutatási Ösztöndíj (bo_328_21) támogatásával készült.
2022. május 21. szombat, 10:30 – 11:30, Radiofarmakológia
1. 68Ga-MAA helyi előállítása, minőség ellenőrzése és a klinikai forgalomban lévő referencia 99mTc-MAA termék összehasonlítása
Jánoki Gergely1, Szeredy Patricia2, Gyónfalvi Szilvia1, Prontvai Bence1, Jánoki Győző1
1: Medi-Radiopharma Kft, Érd, 2: Radiopharmacy Laboratórium Kft, Budaörs
Bevezetés: Vizsgálatunk célja, a már kereskedelmi forgalomban lévő 99mTc-Makro-albumon termék összehasonlítása a helyileg előállítható 68Ga-al jelzett MAA termékkel, a nukleáris medicinában a SPECT felhasználás mellett a PET felhasználások irányába való előrehaladás érdekében.
Anyag és módszer: A Ga-generátor elúció során nagytisztaságú tracer oldatokat használtunk, majd a megfelelő pH érték beállításához acetát és nátrium-hidroxidos PBS puffert alkalmaztunk. A Medi-Radiopharma Kft által gyártott különböző hatóanyag tartalmú Makro-Albumon ampullákat nagytisztaságú vízben oldottuk, majd a natív és aggregált HSA szeparálásának érdekében centrifugáltuk a szuszpenziót, a vizsgálatokat elvégeztük nem centrifugált szuszpenziók esetében is. A szuszpenziót közepes aktivitású pufferált Ga-68 eluátummal jeleztük meg. A legmegfelelőbb jelzési hatásfok megtalálásának érdekben az inkubálási időt és hőmérsékletet több időpontban és hőfokon vizsgáltuk. A jelzett készítmény stabilitását nem szűrhető radioaktivitás mérésével és vékonyréteg kromatográfiával ellenőriztük, a jelzés és az inkubálási idő utáni 2 órában. A stabilnak bizonyult készítmények biodisztribúcóját Han Wistar patkányokon végeztük. A jelzett készítmények szemcseméret számát és eloszlását fénymikroszkóp segítségével vizsgáltuk meg a jelzés után. A Ga-68-al jelzett termékek eredményeit a referens Tc-99m-el jelzett MAA eredményekkel hasonlítottuk össze. A vizsgálatokat a 2020-1.1.2-Piaci-KFI-2020-00057 pályázat támogatásából végeztük.
Eredmények: A vizsgálatok során megtaláltuk az eddigi legmegfelelőbb jelzési hatásfokhoz szükséges időt és hőfokot mely a 20 perces inkubálás 60 C-on bizonyult. A készítmények a jelzési hatásfokai a jelzési időtől számított 2 órán belül 90% feletti eredményeket mutattak. A biodisztribúciós vizsgálatok Han Wistar patkányokon a tüdőben nagy mennyiségű halmozódást mutattak melyek az injetált dózis 80%-át jelentették. A féymikroszkópos összehasonlítások nem mutattak szignifikáns különbséget a 68Ga-MAA és referens termék összehasonlítása során, minden esetben 90%-ban 10-80 µm közötti részecskeméretet és eloszlást tapasztaltunk.
Következtetés: A klinikumban jelen levő MAA termék jelezhető Ga-68 izotóppal, melynek stabilitása 2 órán belül kielégítő. A további stabilitási és jelzési hatásfok optimalizálásához további inkubációs időket és hőfokokat fogunk vizsgálni. A stabilizált termékek biodisztribúcióját további patkány állatkísérletek mellett fogjuk vizsgálni.
2. Perfúziós radiofarmakonok: a „gold standard” és versenytársai
Környei József, Szemenyei Erzsébet, Szűcs Péter, Mikecz Pál
Izotóp Intézet Kft., Kutatás és fejlesztés, Budapest
Bevezetés: A vérátáramlás kvantitatív meghatározása fontos a kardiológiai, onkológiai és kardio-onkológiai esetekben mind a diagnosztika, mind a prognózis szempontjából. „Gold standard”-nak tartják a [15O]víz készítményt, amelynek alkalmazása azért messze nem kizárólagos.
Anyag és módszer: Releváns közleményeket alapul véve elemezzük a perfúziós radiofarmakonok felvételi és lokalizálódási mechanizmusát, ill. a hazai alkalmazhatóságot, hozzáférhetőséget. Ebben szerepet kap a francia NAOGEN Pharma és az Izotóp Intézet Kft. közötti együttműködés, amely a 82Sr/82Rb generátor budapesti gyártásának megvalósítására irányul.
Eredmények: A szívizom vérátáramlás kvantitatív meghatározására a törzskönyvezett [15O]víz, [13N]ammónia és a [82Rb]klorid, továbbá a klinikai kipróbálás alatt lévő [18F]flurpiridaz szerepel a 2021-ben megjelent európai irányelvben1. A három törzskönyvezett radiofarmakon három különböző mechanizmussal vevődik fel a sejtekben: szabad diffúzióval, a párhuzamosan végbemenő aktív transzportot és passzív diffúziót követő metabolizálódással, ill. tisztán aktív transzportban. Az [15O]víz esetében a radiofarmakon sejtbe jutása egyenesen arányos a vérátáramlással, míg a többi ágens lehajló görbét mutat, így ezek értékelésénél szoftveres korrekció szükséges. Az [15O]víz mellett többféle tumorban vizsgálták a [13N]ammónia és a [82Rb]klorid felvételét is, utóbbival kapcsolatban megállapították, hogy egyértelmű összefüggés áll fenn a prosztatarák vérátáramlása és a tumor agresszivitása között2. Kardio-onkológiai vonatkozásban a tumorkezelések okozta kardiotoxicitást [13N]ammóniával és [82Rb]kloriddal is vizsgálták, ugyanakkor az ígéretes ágens a [18F]flurpiridaz3, amely a [99mTc]sestamibihez hasonlóan a mitokondriumhoz kötődik és felvétele összefüggésben áll a membránpotenciállal. Ami az izotópelőállítást illeti, annak idején Debrecenben létezett technológia a 15O és 13N radionuklidokra; a [13N]ammóniával preklinikai vizsgálatokat is végeztek. Ugyanakkor a 82Sr előállításához extrém nagy protonenergiájú (70 MeV-es) ciklotron szükséges, amely együttműködő partnerünk révén áll rendelkezésre. Alkalmazási szempontokat tekintve a [15O]víz és a [13N]ammónia a vizsgálatokkal egy időben működő ciklotront igényel; egy nyugalmi+terheléses vizsgálatpár időigénye 30 perc, ill. 1,5 óra. A 82Sr/ 82Rb generátor bármely PET-centrumba telepíthető, a vizsgálatpár időigénye 30 perc. A budapesti generátorgyártás kooperációban történő megvalósítása jó úton halad, jelenleg a regisztrációhoz szükséges dokumentáción dolgozunk.
Következtetés: A [82Rb]klorid alkalmazási szempontból rendkívül előnyös, állja a versenyt a „gold standard”-del. A hazai generátorgyártás megvalósulása révén bővülhet az ismert koronária megbetegedés vagy annak gyanúja esetén a felnőtt betegekben használható szívizom perfúziós radiofarmakonok kínálata.
Hivatkozások:
- Sciagra R. et al.: EANM proc. guidelines, https://doi.org/10.1007/s00259-020-05046-9
- Johumsen M.R. et al.: EJNMMI 2021, https://doi.org/10.1007/s00259-020-04998-2
- Kelly J.M. et al.: Current Cardiology Reports, https://doi.org/10.1007/s11886-022-01641-4
3. Új modul rendszerű média-fill kit kifejlesztése radiopharmakonok helyi előállítási folyamatának mikrobiológiai ellenőrzésére
Németh Klára1, Jánoki Gergely1,2, Jánoki Győző2
1Radiopharmacy Laboratórium Kft,Budaörs
2Medi-Radiopharma Kft., Érd
Az izotóp laboratóriumokban a legáltalánosabban alkalmazott diagnosztikumok a Tc-99m-mel és a Ga-68-cal jelzett radiofarmakonok, amelyeket legtöbbször parenterálisan használnak fel. Így a helyszíni készítés komoly feladat elé állítja az ott dolgozó szakembereket, mert egyrészt a kész farmakonnak a radiokémiai tisztaság mellett meg kell felelnie a mikrobiológiai tisztaság követelményeinek is, mint a sterilitás és a limit alatti endotoxin tartalom, amelyet csak a megfelelő aszeptikus körülmények biztosításával érhetünk el. Ez utóbbi feltétel ellenőrzésére alkalmas a táptalaj töltéses módszer (média-fill), mellyel a helyszíni radiofarmakon előállítás körülményei szimulálhatók és az eredmények alapján igazolható az aszeptikus gyártási körülmény, és jósolható a készítmény mikrobiológiai megfelelősége is a betegek biztonságos kezelésének érdekében, egészségük védelmében.
Jelen munkában bemutatjuk a Radiopharmacy-Media-Fill kit család négy modulját, amely mindegyike tartalmazza a nukleáris medicina laboratóriumokban végrehajtott aszeptikus műveletek szimulációjához szükséges mikrobiológiai táptalajt (TSB oldat) és steril eszközöket. A Modul-A eszközeivel szimulálhatjuk az aszeptikus radiogyógyszer készítés lépéseit, keverés több komponensből injektálással egy vagy több műveletben. A Modul-B olyan eszközöket tartalmaz, amelyekkel szimulálhatjuk a radiopharmakonok aszeptikus adagolását, szétosztását több dózisra. A Modul-C-vel az aszeptikusan készítendő autológ sejtek preparálását és azok izotóppal jelzett farmakonnal történő jelzésének lépéseit modellezhetjük. A Modul-D a steril szűrés lépését szimulálja és az izotóp generátor eluátumok direkt sterilitás teszteléséhez nyújt érzékeny mikrobiológiai reagenst és eszközöket. Az aszeptikus művelet szimuláció eredményét egyszerű sterilitás tesztben értékeljük. A media-fill teszt eredményeit kiegészítjük környezeti és személyes higiénés monitorozással, amelyhez szükséges reagenst a Radiopharmacy Tisztakörnyezet Készlet tartalmazza. A mikrobiológiai vizsgálatok házon belül is könnyen elvégezhetők. Az aszeptikus művelet teszt kiértékeléssel együtt két hetet vesz igénybe, a higiénes monitor 5 napos inkubálás után értékelhető. A kithez csatolt adat- és eredményközlő lap az eredmények összefoglaló dokumentációját segíti elő könnyen áttekinthető és archiválható formában a laboratóriumi dolgozók, minőségbiztosítók és hatósági inspektorok számára.
A kit moduljai alkalmasak a PET és a SPECT diagnosztikai eljárásokban használt steril, parenterálisan alkalmazott radiofarmakonok (radiogyógyszerek) aszeptikus előállításának szimulációjára, segítségével ellenőrizhetjük az előállításában résztvevő operátorok gyakorlottságát, a kötelező betanulási folyamat végeredményét, valamint a hatóságok számára is demonstrálhatjuk az aszeptikus műveletek biztonságos kivitelezhetőségét.
A kit elve az USP <747> és <825> fejezetében leírt, steril farmakonok komponenseiből történő előállítását célzó aszeptikus műveleteken alapul, továbbá a Ph.Eur 5.19 fejezetében leírt helyben készített parenterális radiopharmakonokra vonatkozó követelményeket veszi figyelembe. A kit alkotóelemei a GMP irányelveinek megfelelő körülmények között készült.
A fejlesztést és megvalósítást a GINOP-2.1.7-15-2016-00744 kutatási projekt támogatta.
4. Új, alternatív 18F-jelzett PSMA specifikus nyomjelzők szintézise, és preklinikai vizsgálata
Eller Gábor1, Fülöp András1, Meskó Zoltán1, Kaleta Zoltán2, Trencsényi György3, Garai Ildikó4, Máthé Domokos5, Tóth Gyula1
1Pozitron-Diagnosztika Kft, Budapest
2Progressio Kft, Budapest
3Debreceni Egyetem, ÁOK, Orvosi Képalkotó Intézet, Nukleáris Medicina Tanszék, Debrecen
4ScanoMed Kft, Debrecen, CROmed Kft, Budapest
Bevezetés: Az alkinok és azidok közötti Cu(I) katalizált cikloaddíciós reakcióúton prosztata specifikus membrán antigénhez (PSMA) szelektíven kötődő, új F-18 izotóppal jelzett radiofarmakon jelöltek tervezését, szintézisét, analitikai és preklinikai karakterizálását végeztük el.
Anyag és módszer: A felhasznált prekurzor vegyületeink a PSMA-specifikus molekularész lizin oldalláncán keresztül, eltérő hosszúságú és szerkezetű linkereket tartalmaztak, amelyek láncvégein egy-egy terminális alkin-csoport volt található. A radiokémiai szintézisekhez ciklotronban előállított 18F izotópot előbb minden esetben [18F]fluoroetilaziddá alakítottuk, majd ezt reagáltattuk az egyes prekurzorokkal. Ehhez Trasis AIO szintézismodulokat saját fejlesztésű szintézisszekvenciákat, és egyszer használatos szerelékeket fejlesztettünk. Minden esetben a radiokémiai munka része volt egy félpreparatív folyadékkromatográfiás (HPLC) elválasztás is. Az in vitro preklinikai mérésekhez 2 sejtvonalat használtunk a PSMA pozitív LnCaP (humán prosztatarák) és a PSMA negatív PC3 (humán prosztatatrák) sejtvonalakat, míg az in vivo mérésekhez LnCaP tumoros egereken kisállat PET illetve PET/MR képalkotó vizsgálatokat végeztünk. A fejlesztést a 2019-1.1.1-PIACI-KFI-2019-00194 pályázati támogatás segítségével végeztük.
Eredmények: Az új PSMA specifikus 18F-jelzett ligandok a jelölő izotópot kovalens kötésben fluoro-etil-triazol gyűrűhöz (FET) kapcsoltan tartalmazták. A radiokémiai szintézisek kielégítő bomláskorrigálatlan radiokémiai hozamot eredményeztek (20-30%, nem optimalizált hozamok), és csak minimális eltérést tapasztaltunk a sorozat egyes tagjainak hozamában. A készítmények radiokémiai tisztasága minden esetben 95% fölötti volt köszönhetően a HPLC-s elválasztásnak. Egy órás besugárzásból származó 18F izotópból kiindulva a formulálás után, steril, izotóniás oldatban kaptuk meg az átlagosan 20GBq radioaktivitású különböző intravénás készítményeket. Az in vitro vizsgálatokból megállapítható volt, hogy valamennyi vizsgált PSMA molekulát célzó radiotracer specifikusan kötődött a PSMA pozitív sejtekhez, valamint minden mért időpontban szignifikánsan (p≤0,05) magasabb (10-50-szeres) falhalmozódást mutatott a PSMA pozitív LnCaP sejtekben, szemben a PSMA negatív PC3 daganatsejtekkel. Az in vivo kisállat PET felvételeket szerint a naftil-molekularészt tartalmazó radiofarmakonok esetén a magas tumor-felvétel mellett alacsony volt a húgyhólyag és magas az epehólyag aktivitása, amely a májon keresztül történő kiürülést igazolja. Ezzel szemben a polárosabb radiotracerek viszonylag gyors kinetikával elsősorban a veséken keresztül ürültek ki az állatok szervezetéből, amely tulajdonság hasznos lehet késői statikus gyűjtési protokollok esetén. Elemezve a kvantitatív adatokat a tumorok jól körülhatárolhatóak voltak alacsony háttér-halmozás mellett, a már klinikai gyakorlatban alkalmazott referencianyagokkal történő összehasonlításban (18F-PSMA-1007, illetve 18F-JK-PSMA-7) a referencianyagokhoz közelítő, magas SUV értékeket kaptunk az új sorozat egyes tagjai esetén.
Következtetés: Bizonyítottuk, hogy az új [18F]FET-PSMA típusú radiofarmakonok akár klinikai célokra is elegendően magas hatásfokkal és megfelelő minőségben állíthatók elő. A sorozat legjobban teljesítő egy-két tagját további, klinikai vizsgálatokra is alkalmasnak látjuk.
5. [68Ga]Ga-PSMA-11 gyógyszerészeti fejlesztése és az „Investigational Medicinal Product Dossier” összeállítása humán klinikai fázis III vizsgálatokhoz
Farkasinszky Gergely, Dénes Noémi, Ésik Zsuzsanna, Kertész István, Miklovicz Tünde, Németh Enikő, Rubleczky Béla, Pótári Norbert, Varga Flóra, Forgács Viktória, Jószai István, Balkay László, Trencsényi György
Debreceni Egyetem Általános Orvostudományi Kar Orvosi Képalkotó Intézet Nukleáris Medicina Tanszék, Debrecen
Bevezetés: Hazánkban a gyógyszerek jogi környezetét a 2005. évi XCV. törvény határozza meg. Az elmúlt évek során aktuálissá vált a 68Ga-mal jelzett Prosztata Specifikus Membrán Antigén (PSMA) képalkotás megvalósítása, mivel a generátor magas ára és a 18F izotóppal jelzett radiogyógyszerek megjelenése kiszorította azokat a tradicionálisan klinikai vizsgálatokban résztvevő nyugat-európai PET centrumokból, így gátolva a már lefolytatott humán fázis vizsgálatok (fázis I és II) képalkotási protokollokban definiált folytonosságát.
Anyag és módszer: A radiogyógyszer előállítását GMP körülmények között valósítottuk meg. Radionuklid forrásként gyógyszer minőségű 68Ge/68Ga generátort használtunk (Eckert-Ziegler art no:10056-00). Scintomics GRP modult alkalmaztunk a szintézis megvalósítására, így a folyamat automatizáltsága biztosított volt (Hot cell: von Gahlen 1737). A terméket az Európai Gyógyszerkönyvben definiált (Ph. Eur. 10.4, 03044) minőségellenőrző vizsgálatoknak vetettük alá.
Eredmények: A [68Ga]Ga-PSMA-11 oldatos injekció steril, tiszta, színtelen vagy enyhén sárgás mikrobiológiai tartósítószert nem tartalmazó oldat, pH tartománya 4-8 közötti érték volt. A készítmény többadagos injekció. Radiokémiai tisztasága >95 % a lejárati idő végéig. A radioaktív koncentráció a referencia időre vonatkoztatva 75-10 MBq/ml, a szintézis végtérfogata 16 ml ± 10% volt. Egy injekciós üveg minimum 1,0 ml, maximum 8,0 ml oldatot tartalmazott. A maximálisan beadható injekciós térfogat 8,0 ml (injekciós üveg maximális térfogata). A referencia időre vonatkoztatva egy injekciós üveg minimum 10 MBq, maximum 600 MBq radioaktivitást tartalmazott. A [68Ga]Ga-PSMA-11 oldatos injekció javasolt felhasználhatósági ideje a szintézis végétől számított 2 óra. A gyógyszerkészítmény formulálása intravénás gyógyszerbeviteli módnak megfelelően történt. A hatóanyaggyártás és az injekció formulálás folyamata térben és időben nem választható el egymástól. A gyógyszerformulálás tulajdonképpen a hatóanyaggyártás utolsó lépésénél, a szilárdfázisú oszlopon megkötött hatóanyag víz-etanol 1:1 arányú oldatával (2 ml) történő elúciójával kezdődött. Ezt követően az eluátumot PBS-pufferrel elegyítettük, aminek eredményeként jutottunk a hatóanyag fiziológiás oldatához. A formulálás utolsó fázisa az oldat injekciós üvegbe töltése, amely folyamat magába foglalta a készítmény sterilitását biztosító baktériumszűrést (0,22 µm pórusátmérőjű „vented” membránszűrő) is.
Következtetés: A gyógyszerészeti fejlesztés során a gyógyszerkönyvnek megfelelő minőségű és a GMP klinikai vizsgálati készítményekre vonatkozó elvárásrendszerének megfelelő terméket állítottunk elő, ami alapján az Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet elfogadta azt, mint klinikai vizsgálati készítmény.
6. DOTAGA-trastuzumab molekula előállítása és 52Mn izotóppal történő jelzése
Vágner Adrienn1, Nagy Gábor1, Szikra Dezső1,2
1Scanomed Kft, Debrecen
2Debreceni Egyetem Klinikai Központ Orvosi Képalkotó Klinika Nukleáris Medicina Intézet, Debrecen
Bevezetés: Az emlőrák az egyik leggyakrabban előforduló daganatos betegség a nők körében világszerte. Az invazív emlőrákok mintegy 20%-át HER2-pozitívnak minősítenek, amely egy agresszív lefolyású tumor típust jelöl. Jelenleg a HER2 expresszió szintjének meghatározásához invazív, biopsziás módszert alkalmaznak (IHC vagy FISH), azonban ezen vizsgálatok eredményeinek kb. 20%-a pontatlan. A HER2 pozitív daganatok funkcionális állapotának meghatározásában a molekuláris képalkotás, azon belül is a pozitron emissziós tomográfia (PET) jelenthet non-invazív megoldást. Ezen túl kritikus fontosságú lehet a HER2 célzott terápiára történő beválogatásban, illetve az immunterápia során történő HER2 állapot változásának a követésében. A HER2 pozitív daganatok kezelésére alkalmazott trastuzumab monoklonális antitest a molekuláris képalkotásban is alkalmazható, mert a célpontjára specifikus és radioizotóppal jelölt formái kémiailag kényelmesen és gyorsan előállíthatóak. A mangán-52 (52Mn) izotóp fizikai tulajdonságainak (t1/2 = 5.59 nap, β(+) = 29.6%, Eβ,ave = 240 keV) köszönhetően ideális párja lehet a trastuzumab antitestnek a PET vizsgálatok során, vagy akár kétmodalitású mangán-erősített mágneses rezonanciás képalkotásban is (MEMRI). Mivel a radiofém alapesetben nem kötődik az antitesthez, emiatt a komplexálás elősegítése érdekében kelátor alkalmazása szükséges.
Anyag és módszer: Kutatásunk során a konvencionális DOTA-GA kelátor alkalmazásával dolgoztuk ki az antitestek konjugálási módszerét, valamint a DOTA-GA-trastuzumab 52Mn izotóppal történő jelzési módszerét. A kísérletek során a kelátor aktív csoportjának konjugálásra gyakorolt hatását DOTA-GA-pSCN-Bn, DOTA-GA-anhidrid és DOTA-GA-maleimid alkalmazásával vizsgáltuk. Ezen túl a puffer minőségének, a reakció hőmérsékletének és a kelátor koncentrációjának változtatásával optimalizáltuk a konjugálási reakciót. A konjugálás konverzióját tömegspektrométerrel kapcsolt ultranagy-hatékonyságú folyadék kromatográffal (UHPLC-MS) követtük. A konjugálás elvégzése után kidolgoztuk a minőségellenőrzési módszerét a 52Mn-DOTA-GA-trastuzumabnak UHPLC és TLC rendszeren is és optimalizáltuk a jelzési reakció körülményeit a pH és ligandum koncentráció változtatásán keresztül, így elkészítve a radiofarmakon gyártási protokollját a későbbi in vivo vizsgálatokhoz.
Eredmények: A legjobb konjugálást szobahőmérsékleten, nátrium-hidrogénkarbonát pufferben pH=8-on sikerült elérni. A DOTA-GA-pSCN-Bn kelátor esetén sikerült a legalacsonyabb koncentráció mellett a legnagyobb hatásfokot elérni. A DOTA-GA-trastuzumab 52Mn izotóppal történő jelölését pH=6-on végeztük, nátrium-acetát puffer használatával.
Konklúzió: Kísérleteink során sikeresen előállítottuk a 52Mn-DOTA-GA-trastuzumabot, amely alkalmas a HER2 pozitív emlőtumorok képalkotására.
7. Ex tempore radiofarmakonok gyógyszerész szemmel
Baráthné Tóth Eszter1, Szerdahelyiné Dékány Márta1, Tóth Gyula1
1Pozitron-Diagnosztika Kft, Budapest
Bevezetés: A nukleáris medicina fejlődéséhez, a diagnosztikai és terápiás lehetőségek bővítéséhez elengedhetetlen új, a klinikai gyakorlatba frissen bevezetett, betegség specifikus radiogyógyszerek előállítása és humán alkalmazása. Az ex tempore előállított radioaktív gyógyszer egy olyan innovatív diagnosztikai vagy terápiás készítmény, ami törzskönyvezés nélkül bármely olyan intézményben készülhet, ahol teljesülnek a Európai Gyógyszerkönyv (Ph.Eur.) 5.19. fejezetében (Extemporaneous preparation of radiopharmaceuticals) tárgyalt feltételek. Ezek a készítmények speciális betegszükségleteket elégítenek ki, az orvos saját felelősségére rendelheti betegének. A Gyógyszertörvény (2005. évi XCV. törvény) a 2018. évi módosítása után biztosítja a jogszabályi hátteret Magyarországon is ilyen radiofarmakonok előállításához.
Anyag és módszer: Az ex tempore radiofarmakonok gyártásához szükséges laboratóriumi és műszeres feltételek megteremtése során üzembe állítottunk egy új tisztatéri laboratóriumot „D” tisztasági fokkal. Az itt elhelyezett izolátor forrófülkék és radiokémiai szintézismodulok teljesítik nemcsak a Ph.Eur 5.19. fejezetének követelményeit, de még a szigorúbb, helyes gyógyszergyártási gyakorlat (cGMP) követelményeit is. Hasonló módon a minőségellenőrzési vizsgálatok során használt analitikai műszereket is megfelelően kvalifikáltuk, számítógépes rendszerüket validáltuk. Az első ex tempore előállított 18F-JK-PSMA-7 radiofarmakon engedélyének megszerzése előtt végrehajtottuk a teljes gyártási folyamat validálását, és a minőségellenőrzési vizsgálatok analitikai módszereinek validálását, valamint media fill vizsgálatot végeztünk az injekciós készítmény kiszerelése során használt töltő berendezésen (Phaedra/Clio, Comecer). Hasonlóan jártunk el a második ex tempore készítményünk, a 18F-PSMA-1007 engedélyezése előtt is, ebben az esetben az alkalmazott töltő berendezés a BBST/Argo-T volt ugyancsak cGMP megfelelőséggel. E radiofarmakon kifejlesztését a 2019-1.1.1-PIACI-KFI-2019-00194 pályázati támogatás segítségével végeztük.
Eredmények: A Pozitron-Diagnosztika Kft. 2019-ben megnyitotta a sort a hazai előállítású ex tempore radiofarmakonok előtt azzal, hogy megszerezte a gyártási engedélyt a 18F-JK-PSMA-7 radiofarmakonra. Az OGYÉI Hatósági Ellenőrzési Osztálya inspekció során győződött meg a Gyógyszerkönyv 5.19. fejezetében leírt követelményeknek való megfelelésről, mielőtt kiadta volna az előállítási engedélyt, amelynek birtokában 2020 év eleje óta folyik a PozitronScan-PSMA7 készítmény gyártása, és azzal PET/CT vizsgálat intézményünkben. Jelenleg a 18F-PSMA-1007 készítményünk engedélyezése zajlik, melynek során már az OGYÉI Kémiai Értékelő Osztálya is részt vesz a folyamatban. Az OGYÉI sikeres helyszíni ellenőrzése megtörtént, az engedély kiadását várjuk, amelynek birtokában ezzel a radiofarmakonnal is megkezdhetjük a klinikai vizsgálatokat.
Következtetés: Ex tempore radiofarmakonok engedélyezésével megvalósíthatóvá válik, hogy a magyar betegek ne külföldön, hanem itthon juthassanak hozzá új, innovatív, a nemzetközi tapasztalatok alapján bizonyítottan hatékony, de forgalomba hozatali engedéllyel még nem rendelkező izotópdiagnosztikai és izotópterápiás radiofarmakonokhoz anélkül, hogy az új készítmények törzskönyvezéséhez szükséges 10 éves klinikai tapasztalatok összegyűjtését ki kelljen várni.
POSZTEREK
1. Módszerfejlesztés a klinikumban használt Tc-99m Leuco-Scinttel jelzett leukocita szeparálásra
Szeredy Patricia1, Jánoki Gergely2, Jánoki Győző2, Gyónfalvi Szilvia2, Prontvai Bence2
1: Radiopharmacy Laboratórium Kft, Budaörs, 2: Medi-Radiopharma Kft, Érd
Bevezetés: Vizsgálatunk célja, a lassú és több fiziológiai paraméter által befolyásolt gravitációs szedimentációt lecseréljük egy gyorsított előcentrifugálásos módszerre, mely a kórházi életbe könnyebben beilleszthető. Az előcentrifugálásos módszer által a nyitott szeparálás gyorsabban és biztonságosabban elvégezhető.
Anyag és módszer: Vizsgálatainkat több különböző donor aznapi friss véréből végeztük, kis molekula súlyú 6%-os HES és ACD-A oldattal. A kiindulási vértérfogatok 40-60 ml, melyeket 50 ml-es centrifuga csövekbe osztottunk szét 20 ml-ként 3 ml 6%-os HES és 2 ml ACD-A oldattal keverve. A vizsgálatok során a gravitációs ülepedéssel szeparált leukociták jelzési hatásfokát hasonlítottuk össze a centrifugálással ülepítettek jelzési hatásfokával. A jelzési hatásfok vizsgálata Tc-99m-el jelzett Leuco-Scint ampullákkal történt. Az elő centrifugálást különböző relatív centrifugálási erővel és idővel végeztük; 5 G és 10 G centrifugális erővel, 5-10-15 perces időket összehasonlítva. Az ülepítés eredményét a vizuális összehasonlítás mellett fénymikroszkóp alatt is megvizsgáltuk. Összehasonlítottuk a centrifugált fehérvérsejtek mennyiségét és életképességét a gravitációsan szedimentált sejtekkel szemben fénymikroszkóp alatt. A vizsgálatokat a 2020-1.1.5-GYORSÍTÓSÁV-2021-00005 pályázat támogatásából végeztük.
Eredmények: A vizuális vizsgálatok során megállapítható, hogy a centrifugálásos ülepítés esetében a felülúszóban maradt vörösvérsejtek mennyisége magasabb, mely a további centrifugálási lépéseknél is jelen volt. A fénymikroszkópos vizsgálat a szeparált fehérvérsejtek mennyiségében és életképességében nem mutatott szignifikáns különbséget a két módszer között. A jelzési hatásfokban sem jelenik szignifikáns különbség; a gravitációsan ülepített sejtek jelzési hatásfoka átlagosan 85%, míg a centrifugálással szeparált sejteké átlagosan 80%.
Következtetés: További centrifugálási erő és idő paraméterek vizsgálata után az új gyorsított és biztonságosabb módszer alkalmazható a klinikumban.
2. Radiokémiai tapasztalatok a 18F-PSMA-1007 és a 18F-JK-PSMA-7 humándiagnosztikai célokra történő előállítása kapcsán
Murad Mohammed1 , Eller Gábor1, Fülöp András1, Szerdahelyiné Dékány Márta, Meskó Zoltán1, Tóth Gyula1
1Pozitron-Diagnosztika Kft, Budapest,
Bevezetés: A 18F-JK-PSMA-7 és 18F-PSMA-1007 nyomjelző molekulák a prosztata specifikus membrán antigénhez (PSMA) szelektíven kötődő 18F izotóppal jelzett radiofarmakonok. A 18F-PSMA-1007 hatóanyagának általunk is alkalmazott egyreaktoros szintézismódszerét a német Medical University of Heidelberg, az ABX Dresden, valamint a belga Trasis SA közösen fejlesztették ki. A 18F-JK-PSMA-7 egylépéses szintézismetodikáját pedig a német FZ-Jülich és a University of Köln módszerét adaptálva a AIO típusú szintézismodulokra a Trasis SA belga cégtől vettük át.
Anyag és módszer: A rutin gyártások során mindkét radiofarmakon szintézise estén ciklotronban előállított 18F izotópból (<370GBq besugárzás végén) indulunk ki, mindkét esetben tetrabutil-ammónium-hidrogénkarbonátot használtunk a 18F izotóp fázisátviteléhez. Az izotóp beépítését a 18F-JK-PSMA-7 esetén 75 oC-on acetonitrilben végezzük, és a prekurzor vegyület tercbutil védőcsoportokat tartalmaz, amelyeket egy következő lépésben foszforsavas hidrolízissel tudjuk eltávolítani. A 18F-PSMA-1007 esetén 105 oC-on dimethil-szulfoxidban történik a 18F beépülése, azonban itt a prekurzor molekula nem tartalmaz védőcsoportokat. A 18F-JK-PSMA-7 tartalmú reakcióelegyet XBridge Shield C18 oszlopon félpreparatív oszlopon tisztítjuk, és a tiszta 18F-JK-PSMA-7 tartalmú frakciót formuláljuk egy C18 tölteten történő szilárdfázisú extrakciós lépésben. A 18F-PSMA-1007 esetén a reakcióelegyet HPLC-s elválasztás nélkül, egy egyszerű PS H+, és egy C18 töltetekből álló szilárdfázisú rendszeren tisztítjuk etanol/víz változó összetételű elegyével. Mindkét estben a tiszta végterméket (70-120 GBq, szintézis végén) néhány százaléknyi etanolt, és nátrium-aszkorbátot tartalmazó fiziológiás sóoldatban kapjuk meg. A 18F-PSMA-1007 radiofarmakon kifejlesztését a 2019-1.1.1-PIACI-KFI-2019-00194 pályázati támogatás segítségével végeztük.
Eredmények: Minkét folyamat esetén SNAr típusú reakcióban a 18F beépítése közvetlenül a radiofarmakon végleges vázával azonos prekurzor molekulák egy nikotinsav származékot tartalmazó végén, ezért a teljes szintézisidők viszonylag rövidek (60 perc – 18F-JK-PSMA-7, illetve 40 perc – 18F-PSMA-1007). A 18F-JK-PSMA-7 esetén a reakcióidő hosszabb volt, mivel itt a beépülés utáni hidrolízis lépés, valamint a HPLC-s elválasztás időigényét is számításba kellett venni. A radiokémiai szintézisek kiváló bomláskorrigált radiokémiai hozamot eredményeztek (45%, n=25 – 18F-JK-PSMA-7, illetve 52%, n=5 – 18F-PSMA-1007). A készítmények radiokémiai tisztasága a 18F-JK-PSMA-7 estén közel 100 %-os volt (>98% n=25), míg a 18F-PSMA-1007 esetén 91% (n=5) fölötti volt.
Következtetés: Mind a 18F-JK-PSMA-7, mind a 18F-PSMA-1007 radiofarmakon klinikai célokra bőven elegendő mennyiségben, megfelelő minőségben, és kémiai stabilitásukat legalább 12 óráig megtartva állíthatók elő a Pozitron-Diagnosztika radiokémiai laboratóriumaiban. Mindkét módszer megbízható, rutin gyártásokra alkalmas a validálási eredmények tükrében. Az ex tempore engedély kiadása óta eltelt 2 évben 18F-JK-PSMA-7 radiofarmakon segítségével összesen ezer fölötti beteg vizsgálatát végeztük el intézményünkben. A 18F-PSMA-1007 radiofarmakon gyártási engedélyének kiadása pedig jelenleg folyamatban van.
3. A [68Ga]Ga-PSMA-11 tartalmú radiogyógyszer klinikai vizsgálati engedélyének megszerzéséhez szükséges minőségellenőrző HPLC eljárás kifejlesztése és alkalmazása
Varga Flóra, Farkasinszky Gergely, Ésik Zsuzsanna, Dénes Noémi, Kertész István, Miklovicz Tünde, Németh Enikő, Rubleczky Béla, Forgács Viktória, Jószai István
Debreceni Egyetem Általános Orvostudományi Kar Orvosi Képalkotó Intézet Nukleáris Medicina Tanszék, Debrecen
Bevezetés: A Debreceni Egyetem Orvosi Képalkotó Intézetében kifejlesztésre került a [68Ga]Ga-PSMA-11 tartalmú radioaktív gyógyszerkészítmény, amely hatóanyaga egy 68Ga izotóppal jelzett prosztata specifikus membrán antigén ligandum. Egy nemzetközi gyógyszeripari szponzor megbízásából valósult meg a projekt, a forgalomban lévő terméke indikációs területének kibővítési lehetőségének alátámasztása érdekében, melyhez klinikai vizsgálatok elvégzése szükséges. A klinikai vizsgálat engedélyeztetése céljából szükséges a minőségellenőrzési vizsgálatok kidolgozása. Munkánk célja az injekciós készítmény radiokémiai tisztaságának meghatározására alkalmas kromatográfiás eljárás kifejlesztése és alkalmazása volt.
Anyag és módszer: A kromatográfiás vizsgálatokat az alábbi összetételű Jasco típusú nagyhatékonyságú folyadékkromatográfiás (HPLC) berendezéssel végeztük: kis nyomású gradiensképző (LPG) kvaterner szelep rendszer, PU-2080 HPLC pumpa, AS-910 automata mintaadagoló, UV-2075 PDA detektor, saját készítésű radioaktivitás detektor, ChromNav kiértékelő- és vezérlő szoftver. A kísérletekhez Supelcosil LC-18-DB 150 x 3 mm, 3 µm és Kinetex XB-C18 50 x 4,6 mm, 2,6 µm típusú kolonnákat használtunk. A módszerfejlesztés során [natGa]Ga-PSMA-11, [68Ga]Ga-PSMA-11 és [68Ga]GaCl3 referencia anyagokat alkalmaztunk.
Eredmények: A HPLC eljárás kidolgozása alkalmával az Európai Gyógyszerkönyvi ajánlást optimalizáltuk. Az általunk ajánlott kromatográfiás körülmények a következőek lettek: A eluens: 0,1% TFA vízben, B eluens: 0,1% TFA acetonitrilben; gradiens elúció: 95% A eluens, 5% B eluens 0 perc, 65% A eluens, 35% B eluens 10 perc; injektált térfogat: 20 µl, detektálási hullámhossz: 280 nm, áramlási sebesség: 0,6 ml/min. A kromatogramon a [natGa]Ga-PSMA-11 komponens két csúcs formájában jelenik meg, amelyek a referenciaanyag egy-egy sztereoizomerjeihez tartoznak. A kifejlesztett módszerrel a két izomer megfelelő 2,07±0,03 felbontással és 16 perces vizsgálati idővel elválasztható. A módszervalidálás során az alábbi paramétereket vizsgáltuk: linearitás (R2>0,9992), tartomány (1,02–44,38 MBq/ml) és visszanyerés (78,9-102,4%). A kidolgozott kromatográfiás eljárás segítségével megvizsgáltuk három gyártási tétel radiokémiai tisztaságát, ami 98,59-99,58% közötti érték volt. A készítmény lejárati idejéig monitorozott stabilitás vizsgálat során a radiokémiai tisztaság 98,59% feletti volt.
Következtetés: A munkánk során kifejlesztett HPLC eljárást sikeresen alkalmaztuk a készítmény radiokémiai tisztaságának meghatározására. A vizsgálati protokollt, a validálási-, stabilitási- és batch analízis eredményeket beillesztettük az OGYÉI (Országos Gyógyszerészeti és Élelmezés-egészségügyi Intézet) számára benyújtandó IMPD (Investigational Medicinal Product Dossier) dokumentációba, ami a készítmény klinikai vizsgálati engedélyének megszerzéséhez szükséges. Az engedélyeztetési eljárás eredményeképpen a hatóság jóváhagyta az analitikai vizsgálatokat és engedélyezte a klinikai vizsgálatok megkezdését.
4. Agytumorok PET leképezésére alkalmas radiogyógyszerek enantiomer tisztaságának folyadékkromatográfiás meghatározása oszlop előtti származékképzéssel
Balla Viktória, Törő Gréta, Csoma Szilvia, Forgács Viktória, Jószai István
Debreceni Egyetem Általános Orvostudományi Kar Orvosi Képalkotó Intézet Nukleáris Medicina Tanszék, Debrecen
Bevezetés: A Debreceni Egyetem Orvosi Képalkotó Intézetében agytumorok diagnosztikájára jelenleg két PET radiogyógyszer áll rendelkezésre: L-[11C]metionin és L-[18F]fluoroetil-tirozin. A készítmények humán felhasználásának egyik feltétele a 90% feletti enantiomer tisztaság. A D- és L-izomerek elválasztására az Európai Gyógyszerkönyv (Ph. Eur.) folyadékkromatográfiás elválasztást ajánl királis analitikai kolonna alkalmazásával. Ugyanakkor a költséges eljárás kiváltható fordított fázisú állófázis használatával oszlop előtti származékképzés mellett. A munkánk célja olyan nagyhatékonyságú folyadékkromatográfiás (HPLC) elválasztás kifejlesztése volt, amely során az enantiomerek hatékony elválasztásához N-izobutiril-L-cisztein és O-ftálaldehid származékképzőt alkalmazunk a mintaelőkészítés során.
Anyag és módszer: A kromatográfiás vizsgálatokat az alábbi összetételű Jasco típusú HPLC berendezéssel végeztük: kis nyomású gradiensképző (LPG) kvaterner szelep rendszer, PU-2080 HPLC pumpa, AS-910 automata mintaadagoló, UV-2075 PDA detektor, saját készítésű radioaktivitás detektor, ChromNav kiértékelő- és vezérlő szoftver. A kísérletekhez Phenomenex C18 250 × 4,6 mm; 5 µm és Lichrospher RP-18 250 × 4,6 mm; 5 µm típusú kolonnákat használtunk. A módszerfejlesztéshez analitikai minőségű vegyszereket választottunk, melyek a Merck és VWR termékei voltak.
Eredmények: Az L-[11C]metionin vizsgálata során Phenomenex C18 250 × 4,6 mm; 5 µm típusú állófázist használtunk. A mérés indításakor 0,1% foszforsav-oldat és acetonitril 95/5 V/V%-os elegyét alkalmaztuk, majd ezt követően 12 percig 60/40 értéken tartottuk ezt az arányt. Az áramlási sebesség 1,5 ml/perc volt. A komponenseket 334 nm hullámhosszon detektáltuk. A minta D- és L-izomerjei >3,1 felbontással eluálódtak. A vizsgálati idő 15 percnek adódott. Az L-[18F]fluoroetil-tirozin vizsgálata alkalmával Lichrospher RP-18 250 × 4,6 mm; 5 µm (Merck) kolonnát alkalmaztunk. Az optimális áramlási sebesség 0,6 ml/perc volt. Az alábbi gradiens elúciót javasoljuk az optikai izomerek elválasztására: 0 perc 0,1% foszforsav-oldat/acetonitril 40/60 V/V%, 50 perc 0,1% foszforsav-oldat/acetonitril 0/100 V/V%. Az elérhető felbontás 1,6. A mérési idő 25 perc. A kifejlesztett módszerek validálását az International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use (ICH) irányelveinek megfelelően végeztük el. Meghatároztuk a módszerek linearitását (R2=0,9989-0,9999), ismételhetőségét (RSD%=0,9-1,9%), specifikusságát (RS=1,6-3,1).
Következtetés: A munkánk során kifejlesztett HPLC eljárások sikeresen alkalmazhatók a L-[11C]metionin és L-[18F]fluoroetil-tirozin rutin minőségellenőrzésekor. A módszerek segítségével megbízható eljárás válik elérhetővé a vizsgált PET radiogyógyszerek enantiomer tisztaságának költséghatékony meghatározására.
A MONT XXII. Kongresszus Tudományos Bizottsága:
Nukleáris Medicina klinikum:
Dr. Besenyi Zsuzsanna, PhD
Dr. Györke Tamás, PhD
Dr. Schmidt Erzsébet, PhD
Nukleáris Medicina preklinikum:
Dr. Trencsényi György, PhD
Technikai vizsgálatok:
Dr. Varga József, PhD
Dr. Séra Emese, PhD
Radiofarmakológia:
Antalffy Mária
Dr. Tóth Gyula
PÁLYÁZATI FELHÍVÁS
A Hevesy György Magyar Orvostudományi Nukleáris Társaság XXII. Kongresszusa 2022. május 19-21. között kerül megrendezésre Szegeden.
A korábbi évekhez hasonlóan a MONT Alapítvány pályázatot hirdet az alábbi témakörökben.
- MONT Izotópdiagnosztikai Alapítvány díja: az utóbbi 3 év tudományos tevékenységéért adható, rangos, magas impakt faktorral rendelkező folyóiratban
megjelenő közleményért.
A díj összege 150 000 Ft. - Mediso-díj: újszerű metodikát, vagy régi metodikát újszerű megközelítésben alkalmazó közlemény, előadás vagy poszter (bármely kongresszuson) szerzője számára.
Díj: 100 000 Ft értékű elektronikai eszköz. - Izotóp Intézet díja: a klinikum számára a legnagyobb haszonnal bíró diagnosztikummal, ill. terápiával foglalkozó közlemény, előadás vagy poszter szerzője (bármely
kongresszuson) kapja.
A díj összege 150 000 Ft. - Medinspect díj „A legjobb diagnosztikai prezentációért”: annak az új diagnosztikai eljárást, megközelítést, – akár számítástechnikai fejlesztést is – bemutató kísérletes
munkának a díjazása, amely a gyakorlat számára rövid időn belül bevezethető és alkalmazásának közvetlen terápiás konzekvenciája van.
A díj összege 50 000 Ft. - Medi-Radiopharma – díj: az a diplomás szakember kapja, aki a radiofarmakonok kutatása, előállítása, minőségellenőrzése vagy klinikai alkalmazása területén végzett
munkájáról írt közleményt, vagy tart magas színvonalú előadást, ill. posztert (bármely kongresszuson).
A díj összege 50 000 Ft.
Pályázni lehet a 2019.04.15. és 2022.04.15. között megjelent vagy közlésre elfogadott közleményekkel, illetve bármely magyar vagy külföldi kongresszuson elfogadott előadás
összefoglalókkal. A pályázathoz mellékelni kell a rendelkezésre álló tudományos anyagot, a megjelenés vagy elfogadás bizonyítékát, és a pályázónak egyértelműen jelezni kell, hogy melyik díjra pályázik. Amennyiben egy pályázó több díjra is pályázik ugyanazzal a munkával, kérjük, állítson fel sorrendet, hogy melyik díjat szeretné elsősorban elnyerni.
A pályázatokat a MONT Alapítvány Kuratóriumához kell benyújtani elektronikus úton: dr. Schmidt Erzsébet, kuratóriumi tag részére, email: schmidt.erzsebet@pte.hu
A pályázatok benyújtásának határideje 2022. április 15.
A meghirdetett díjakat a MONT Alapítvány Kuratóriuma szakmai bírálók véleménye alapján ítéli oda a nyertes pályázónak.
Az ünnepélyes eredményhirdetésre a 2022-ben Szegeden rendezendő MONT kongresszus záróünnepségén kerül sor. A kifizetés a jogszabályok által előírt dokumentumok kitöltését kövesét követően történik.
Nagyon reméljük, hogy a fent említett díjazási lehetőségek új motivációt adnak a tudományos kutatáshoz, amelyhez kívánunk jó munkát, kitartást és sok sikert!
MONT Alapítvány Kuratóriuma
A MONT Izotópdiagnosztikai Alapítvány pályázatot hirdet az EANM’22 Kongresszuson való részvétel támogatására 35 év alatti orvosok, kutatók illetve technológusok részére, akik első szerzős előadást vagy posztert nyújtottak be a kongresszusra.
A részletes leírásért kérjük kattintson a “Letöltés” gombra.
Hunguest Hotel Forrás Szeged****
6726 Szeged, Szent-Györgyi Albert u. 16-24.

A négycsillagos konferencia- és wellness szálloda a belvárostól alig 10 perc sétára, Újszegeden, a Tisza partján csodálatos kertvárosi zöldövezetben, a Napfényfürdő Aquapolis Szeged fürdőkomplexummal közvetlen összeköttetésben található.
A szállodában négypályás bowling-pálya bárpulttal, Xbox-szoba, gyermek játszószoba áll a vendégek rendelkezésére. A Zsidró Szalonon belül kozmetika, fodrászat, szolárium, manikűr, pedikűr található.
A szobák felszereltsége: klíma, LCD TV, WIFI, minibár, szobai széf, hajszárító. Az apartmanok és lakosztályok egy része jacuzzival és/vagy kandallóval felszerelt.
A szállóvendégek jogosultak itt tartózkodásuk alatt a fürdőbe való belépésre. Parkolási lehetőség a szálloda saját parkolójában (40 db), illetve a Napfényfürdő mélygarázsában biztosított.
Szobák:




Étterem, lobby bár, kert:



Konferencia termek:


Alaprajz:
XXII. MONT Kongresszus – Kiállítói tájékoztató
XXII. MONT Kongresszus – Kiállítói jelentkezési lap
XXII. MONT Kongresszus – Kiállítótér
Tudományos információ:
Prof. Dr. Pávics László
office.numed@med.u-szeged.hu
Általános információ:
info@regio10.hu
+36 62 710 500
XXII. MONT Kongresszus – Absztrakt űrlap